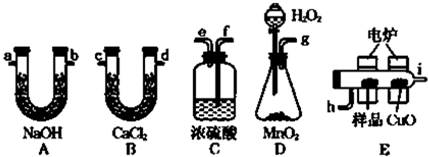
题目内容
工业合成氨的主要反应为:N2(g)+3H2(g)
2NH3(g)(放热反应).下图是工业上合成氨的简要流程示意图,回答下列问题:

①上述流程示意图中的催化剂是 .
②热交换器的作用是 (选填编号).
a.提高N2的转化率 b.充分利用能源,降低成本 c.提高产物的产率
③沿X路线进入压缩机的物质是未反应的N2和H2,循环的目的是 .
④写出一种以氨为原料生产的氮肥 .
| 催化剂 |
| 高温高压 |

①上述流程示意图中的催化剂是
②热交换器的作用是
a.提高N2的转化率 b.充分利用能源,降低成本 c.提高产物的产率
③沿X路线进入压缩机的物质是未反应的N2和H2,循环的目的是
④写出一种以氨为原料生产的氮肥
考点:工业合成氨,化学平衡的调控作用
专题:元素及其化合物
分析:①工业合成氨的催化剂是铁触媒;
②热交换器的作用是充分利用能源,降低成本;
③物质的循环使用可以节约原料,提高利用率;
④合成尿素或硝酸铵或碳酸氢铵必须以氨气为原料.
②热交换器的作用是充分利用能源,降低成本;
③物质的循环使用可以节约原料,提高利用率;
④合成尿素或硝酸铵或碳酸氢铵必须以氨气为原料.
解答:
解:①工业合成氨的催化剂是铁触媒或铁,故答案为:铁触媒或铁;
②热交换器的作用是充分利用反应的热量,利用能源,降低成本,故答案为:b;
③未反应的N2和H2,可以循环使用,这样循环可以提高原料气的利用率,故答案为:提高原料气的利用率;
④合成尿素或硝酸铵或碳酸氢铵必须以氨气为原料,故答案为:尿素或硝酸铵或碳酸氢铵.
②热交换器的作用是充分利用反应的热量,利用能源,降低成本,故答案为:b;
③未反应的N2和H2,可以循环使用,这样循环可以提高原料气的利用率,故答案为:提高原料气的利用率;
④合成尿素或硝酸铵或碳酸氢铵必须以氨气为原料,故答案为:尿素或硝酸铵或碳酸氢铵.
点评:本题考查学生合成氨的原理以及应用等知识,是一道化学和生产联系的考题,难度不大.

练习册系列答案
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案
相关题目
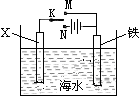 已知海水中含有的离子主要有Na+、Mg2+、Cl-、Br-,利用如图装置进行实验探究,下列说法正确的是( )
已知海水中含有的离子主要有Na+、Mg2+、Cl-、Br-,利用如图装置进行实验探究,下列说法正确的是( )| A、X为锌棒,K置于M,可减缓铁的腐蚀,铁电极上发生的反应为2H++2e-=H2↑ |
| B、X为锌棒,K置于M,外电路电流方向是从X到铁 |
| C、X为碳棒,K置于N,可减缓铁的腐蚀,利用的是外加电流的阴极保护法 |
| D、X为碳棒,K置于N,在X电极周围首先失电子的是Cl- |
以NA表示阿伏加德罗常数,下列说法正确的是( )
| A、25℃,101KPa条件下,24.5L的N2和CO混合气体含有的原子数大于2NA | ||
| B、15.6 g Na2O2与过量CO2反应时,转移的电子数为0.4NA | ||
| C、1 mol SiO2中含有2 mol Si-O单键 | ||
D、14g分子式为CnH2n的(n≥2)链烃中含有的C=C的数目一定为
|
等质量的O2和CO2相比较,下列叙述正确的是( )
| A、体积比为11:8 |
| B、分子个数之比为1:1 |
| C、物质的量之比为11:8 |
| D、原子个数之比为12:11 |
下列离子方程式正确的是( )
| A、向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- |
| B、Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
| C、AlCl3溶液中加入过量的浓氨水:Al3++4NH3?H2O→AlO2-+4NH4++2H2O |
| D、H2SO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+H2O |
下列说法正确的是( )
| A、在一定温度下,AgCl水溶液中Ag+和Cl-浓度的乘积是一个常数 |
| B、催化剂都不参与化学反应,反应前后质量、组成和性质都保持不变 |
| C、应用盖斯定律,可间接计算某些难以直接测量的反应热 |
| D、由于分子间氢键的存在,第VA族氢化物的沸点大小关系为:NH3>SbH3>AsH3>PH3 |
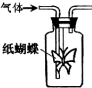 如图集气瓶中用滤纸折成的纸蝴蝶上喷洒了一种溶液,通入某种气体后,实验结果与预测的纸蝴蝶颜色变化不一致的是( )
如图集气瓶中用滤纸折成的纸蝴蝶上喷洒了一种溶液,通入某种气体后,实验结果与预测的纸蝴蝶颜色变化不一致的是( )