题目内容
某温度下,C和H2O(g)在密闭容器里发生下列反应:
C(s)+H2O(g)?CO(g)+H2(g);
CO(g)+H2O(g)?CO2(g)+H2(g).
当反应达到平衡时,c(H2)=1.9mol?L-1,c(CO)=0.1mol?L-1.则下列叙述正确的有( )
C(s)+H2O(g)?CO(g)+H2(g);
CO(g)+H2O(g)?CO2(g)+H2(g).
当反应达到平衡时,c(H2)=1.9mol?L-1,c(CO)=0.1mol?L-1.则下列叙述正确的有( )
| A、CO在平衡时转化率为10% |
| B、平衡浓度c(CO2)=c(H2) |
| C、平衡时气体平均相对分子质量约为23.3 |
| D、其他条件不变时,缩小体积,H2O(g)的转化率随之降低 |
考点:化学平衡的计算
专题:化学平衡专题
分析:氢气来源C与水的反应,CO与水的反应,二氧化碳来源与CO与水的反应,平衡时CO为C与水反应生成CO减去CO与水反应消耗的CO,令碳与水反应生成的氢气的浓度为amol/L,则生成的CO为amol/L,令CO与水反应生成氢气的浓度为bmol/L,则生成的二氧化碳的浓度为bmol/L,消耗的CO浓度为bmol/L,结合氢气、CO浓度计算.
解答:
解:令碳与水反应生成的氢气的浓度为amol/L,则生成的CO为amol/L,令CO与水反应生成氢气的浓度为bmol/L,则生成的二氧化碳的浓度为bmol/L,消耗的CO浓度为bmol/L,
平衡时氢气的浓度为1.9mol/L,则amol/L+bmol/L=1.9mol/L,
平衡时CO的浓度为0.1mol/L,则amol/L-bmol/L=0.1mol/L,
联立解得a=1,b=0.9,
A、CO在平衡时转化率=
×100%=90%,故A错误;
B、故CO2的浓度为0.9mol/L,c(H2)=1.9mol?L-1,故B错误;
C、平衡时时气体为c(H2)=1.9mol?L-1,c(CO)=0.1mol?L-1,CO2的浓度为0.9mol/L,H2O(g)的起始浓度不知你计算平衡水的浓度,不能计算平均摩尔质量,故C错误;
D、其他条件不变时,缩小体积,压强增大,C(s)+H2O(g)?CO(g)+H2(g)平衡逆向进行,CO(g)+H2O(g)?CO2(g)+H2(g)平衡不动,所以H2O(g)的转化率随之降低,故D正确;
故选D.
平衡时氢气的浓度为1.9mol/L,则amol/L+bmol/L=1.9mol/L,
平衡时CO的浓度为0.1mol/L,则amol/L-bmol/L=0.1mol/L,
联立解得a=1,b=0.9,
A、CO在平衡时转化率=
| 0.9mol |
| 1mol |
B、故CO2的浓度为0.9mol/L,c(H2)=1.9mol?L-1,故B错误;
C、平衡时时气体为c(H2)=1.9mol?L-1,c(CO)=0.1mol?L-1,CO2的浓度为0.9mol/L,H2O(g)的起始浓度不知你计算平衡水的浓度,不能计算平均摩尔质量,故C错误;
D、其他条件不变时,缩小体积,压强增大,C(s)+H2O(g)?CO(g)+H2(g)平衡逆向进行,CO(g)+H2O(g)?CO2(g)+H2(g)平衡不动,所以H2O(g)的转化率随之降低,故D正确;
故选D.
点评:本题考查化学平衡的有关计算,难度中等,清楚反应过程是关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
在①大气中二氧化碳增加 ②二氧化硫、二氧化氮排入大气中 ③一氧化碳大量排入大气中 ④冰箱制冷剂氟里昂排入大气中
a.形成酸雨 b.产生温室效应 c.破坏臭氧层 d.使人中毒
以上各项中,呈因果关系的是( )
a.形成酸雨 b.产生温室效应 c.破坏臭氧层 d.使人中毒
以上各项中,呈因果关系的是( )
| A、①-d | B、②-a |
| C、③-c | D、④-b |
某温度下,将3mol A和2mol B充入一密闭容器中,发生下列反应:aA(气)+B(气)?C(气)+D(气),5分钟后达到平衡状态,已知一定温度下,各物质的平衡浓度符合下列关系:[A]a[B]=[C][D],若在温度不变的条件下,将上述容器的体积扩大为原来的10倍,发现A的转化率不发生变化,则B的转化率为( )
| A、60% | B、40% |
| C、24% | D、4% |
下列说法正确的是( )
| A、在其他条件不变时,升高温度可以使平衡向放热反应方向移动 |
| B、在其他条件不变时,使用催化剂只能改变反应速率,而不能使化学平衡移动 |
| C、在容积可变的容器中充入与反应无关的气体,平衡一定不移动 |
| D、在其他条件不变时,增大压强一定会破坏气体反应的平衡状态 |
 实验室常用饱和NaNO2与NH4Cl溶液反应制取纯净氮气,如图.反应式为:NaNO2+NH4Cl═NaCl+N2↑+2H2O;反应放热.试回答:
实验室常用饱和NaNO2与NH4Cl溶液反应制取纯净氮气,如图.反应式为:NaNO2+NH4Cl═NaCl+N2↑+2H2O;反应放热.试回答: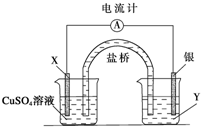 根据下列氧化还原反应2FeCl3+Cu═2FeCl2+CuCl2设计一个原电池:
根据下列氧化还原反应2FeCl3+Cu═2FeCl2+CuCl2设计一个原电池: 汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题.某研究小组在实验室以Ag-ZSM-5 为催化剂,测得NO转化为N2的转化率随温度变化情况如图.
汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题.某研究小组在实验室以Ag-ZSM-5 为催化剂,测得NO转化为N2的转化率随温度变化情况如图.