题目内容
实验要快速制取H2,最好的方法是( )
| A、纯锌和稀H2SO4反应 |
| B、纯锌和浓硫酸反应 |
| C、粗锌和浓H2SO4反应 |
| D、粗锌和稀硫酸反应 |
考点:化学反应速率的影响因素
专题:化学反应速率专题
分析:欲快速制得H2,可升高温度、增大固体的表面积、形成原电池反应,也可适当增大浓度,但不能用浓硫酸.
解答:
解:纯锌与粗锌相比较,粗锌可形成原电池反应,反应速率较大,浓硫酸与锌反应生成二氧化硫气体,不生成氢气,则只有D正确.
故选D.
故选D.
点评:本题考查化学反应速率知识,为高频考点,侧重于影响因素的考查,注意浓硫酸与锌反应生成二氧化硫的性质,难度不大.

练习册系列答案
相关题目
某温度下,将3mol A和2mol B充入一密闭容器中,发生下列反应:aA(气)+B(气)?C(气)+D(气),5分钟后达到平衡状态,已知一定温度下,各物质的平衡浓度符合下列关系:[A]a[B]=[C][D],若在温度不变的条件下,将上述容器的体积扩大为原来的10倍,发现A的转化率不发生变化,则B的转化率为( )
| A、60% | B、40% |
| C、24% | D、4% |
在铁和氧化铁混合物15g中,加入稀硫酸150mL,能发出H21.68L(标准状况).同时铁和氧化铁均无剩余,向反应后的溶液中滴入KSCN溶液,未见颜色变化.为了中和过量的H2SO4,且使Fe2+完全转化成Fe(OH)2,共消耗3mol?L-1的NaOH溶液200mL,则硫酸的物质的量浓度是( )
| A、1.5mol?L-1 |
| B、2mol?L-1 |
| C、2.5mol?L-1 |
| D、3mol?L-1 |
在120℃,101Kpa下,下列各组烃不论以何种比例混合,在足量氧气中点燃,恢复到原状况体积没有变化的是( )
| A、CH4 C2H8 |
| B、C2H4 C2H2 |
| C、C2H2 C2H6 |
| D、CH4 C2H4 |
已知在粗碘中含ICl和IBr,受热时ICl、IBr均可升华;若在粗碘中加入一种物质再进行升华,则可制得精碘.在下列物质中,应加入的物质是( )
| A、H2O |
| B、Zn |
| C、KI |
| D、NaCl |

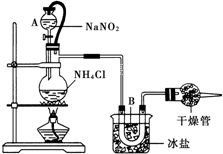 实验室常用饱和NaNO2与NH4Cl溶液反应制取纯净氮气,如图.反应式为:NaNO2+NH4Cl═NaCl+N2↑+2H2O;反应放热.试回答:
实验室常用饱和NaNO2与NH4Cl溶液反应制取纯净氮气,如图.反应式为:NaNO2+NH4Cl═NaCl+N2↑+2H2O;反应放热.试回答: 汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题.某研究小组在实验室以Ag-ZSM-5 为催化剂,测得NO转化为N2的转化率随温度变化情况如图.
汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题.某研究小组在实验室以Ag-ZSM-5 为催化剂,测得NO转化为N2的转化率随温度变化情况如图.