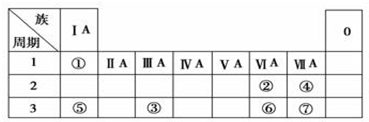
题目内容
制烧碱所用盐水需两次精制.第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、Fe3+、SO42-等离子,过程如下:
Ⅰ.向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ.向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ.滤液用盐酸调节pH,获得一次精制盐水.
(1)过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20℃/g)如下表:
①检测Fe3+是否除尽的方法是 .
②过程Ⅰ选用BaCl2而不选用CaCl2,运用表中数据解释原因 .
③除去Mg2+的离子方程式是 .
④检测Ca2+、Mg2+、Ba2+是否除尽时,只需检测 (填离子符号).
(2)第二次精制要除去微量的I-、IO3-、NH4+、Ca2+、Mg2+,流程示意如下:
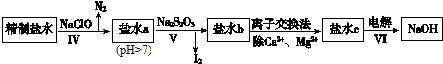
①过程Ⅳ除去的离子是 .
②盐水b中含有SO42-.Na2S2O3将IO3-还原为I2的离子方程式是 .
③过程VI中,在电解槽的阴极区生成NaOH,结合化学平衡原理解释: .
Ⅰ.向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ.向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ.滤液用盐酸调节pH,获得一次精制盐水.
(1)过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20℃/g)如下表:
| CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
②过程Ⅰ选用BaCl2而不选用CaCl2,运用表中数据解释原因
③除去Mg2+的离子方程式是
④检测Ca2+、Mg2+、Ba2+是否除尽时,只需检测
(2)第二次精制要除去微量的I-、IO3-、NH4+、Ca2+、Mg2+,流程示意如下:

①过程Ⅳ除去的离子是
②盐水b中含有SO42-.Na2S2O3将IO3-还原为I2的离子方程式是
③过程VI中,在电解槽的阴极区生成NaOH,结合化学平衡原理解释:
考点:粗盐提纯,物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:(1)①根据检验铁离子的方法进行分析Fe3+是否除尽的方法;
②根据表中数据分析BaSO4与CaSO4的溶解度大小,溶解度越小,沉淀越完全;
③镁离子能够与碳酸根离子反应生成Mg2(OH)2CO3沉淀,从而除去镁离子杂质,据此写出反应的离子方程式;
④根据BaCO3、CaCO3、Mg2(OH)2CO3 的溶解度进行分析;
(3)①次氯酸根离子具有强氧化性,能够氧化铵根离子和碘离子;
②Na2S2O3具有还原性,能够与碘酸根离子发生氧化还原反应,同时被氧化成硫酸根离子,据此写出反应的离子方程式;
③根据电解原理及水的电离平衡H2O?H++OH-进行分析在电解槽的阴极区生成NaOH原理.
②根据表中数据分析BaSO4与CaSO4的溶解度大小,溶解度越小,沉淀越完全;
③镁离子能够与碳酸根离子反应生成Mg2(OH)2CO3沉淀,从而除去镁离子杂质,据此写出反应的离子方程式;
④根据BaCO3、CaCO3、Mg2(OH)2CO3 的溶解度进行分析;
(3)①次氯酸根离子具有强氧化性,能够氧化铵根离子和碘离子;
②Na2S2O3具有还原性,能够与碘酸根离子发生氧化还原反应,同时被氧化成硫酸根离子,据此写出反应的离子方程式;
③根据电解原理及水的电离平衡H2O?H++OH-进行分析在电解槽的阴极区生成NaOH原理.
解答:
解:(1)①检测Fe3+是否除尽的方法为:取少量过程II后的滤液于试管中,滴加几滴KSCN 溶液,若溶液不变红,说明Fe3+已除尽,反之没除尽,
故答案为:取少量过程II后的滤液于试管中,滴加几滴KSCN 溶液,若溶液不变红,说明Fe3+已除尽,反之没除尽;
②硫酸钡的溶度积为2.4×10-4,硫酸钙的溶度积为2.6×10-2,显然硫酸钙的溶度积大于硫酸钡,即BaSO4的溶解度比CaSO4的小,可将SO42-沉淀更完,
故答案为:BaSO4的溶解度比CaSO4的小,可将SO42-沉淀更完;
③镁离子能够与碳酸根离子反应生成难溶物Mg2(OH)2CO3,反应的离子方程式为:2Mg2++2CO32-+H2O═Mg2(OH)2CO3↓+CO2↑,
故答案为:2Mg2++2CO32-+H2O═Mg2(OH)2CO3↓+CO2↑;
④根据步骤数据可知,在BaCO3、CaCO3、Mg2(OH)2CO3 中,BaCO3的溶解度最大,若Ba2+沉淀完全,则说明Mg2+ 和Ca2+也沉淀完全,所以检测Ca2+、Mg2+、Ba2+是否除尽时,只需检测Ba2+即可,
故答案为:Ba2+;
(2)①过程Ⅳ加入次氯酸钠,次氯酸根离子能够氧化NH4+、I-,从而除去杂质NH4+、I-,
故答案为:NH4+、I-;
②盐水b中含有SO42-,Na2S2O3将IO3-还原为I2,Na2S2O3被氧化成硫酸根离子,反应的离子方程式为:5S2O32-+8IO3-+2OH-═4I2+10SO42-+H2O,
故答案为:5S2O32-+8IO3-+2OH-═4I2+10SO42-+H2O;
③电解过程中,H+在阴极上得电子变成H2逸出,使H2O?H++OH-电离平衡向右移动,OH-在阴极区浓度增大,Na+向阴极区移动,最后NaOH在阴极区生成,
故答案为:H+在阴极上得电子变成H2逸出,使H2O?H++OH-电离平衡向右移动,OH-在阴极区浓度增大,Na+向阴极区移动,最后NaOH在阴极区生成.
故答案为:取少量过程II后的滤液于试管中,滴加几滴KSCN 溶液,若溶液不变红,说明Fe3+已除尽,反之没除尽;
②硫酸钡的溶度积为2.4×10-4,硫酸钙的溶度积为2.6×10-2,显然硫酸钙的溶度积大于硫酸钡,即BaSO4的溶解度比CaSO4的小,可将SO42-沉淀更完,
故答案为:BaSO4的溶解度比CaSO4的小,可将SO42-沉淀更完;
③镁离子能够与碳酸根离子反应生成难溶物Mg2(OH)2CO3,反应的离子方程式为:2Mg2++2CO32-+H2O═Mg2(OH)2CO3↓+CO2↑,
故答案为:2Mg2++2CO32-+H2O═Mg2(OH)2CO3↓+CO2↑;
④根据步骤数据可知,在BaCO3、CaCO3、Mg2(OH)2CO3 中,BaCO3的溶解度最大,若Ba2+沉淀完全,则说明Mg2+ 和Ca2+也沉淀完全,所以检测Ca2+、Mg2+、Ba2+是否除尽时,只需检测Ba2+即可,
故答案为:Ba2+;
(2)①过程Ⅳ加入次氯酸钠,次氯酸根离子能够氧化NH4+、I-,从而除去杂质NH4+、I-,
故答案为:NH4+、I-;
②盐水b中含有SO42-,Na2S2O3将IO3-还原为I2,Na2S2O3被氧化成硫酸根离子,反应的离子方程式为:5S2O32-+8IO3-+2OH-═4I2+10SO42-+H2O,
故答案为:5S2O32-+8IO3-+2OH-═4I2+10SO42-+H2O;
③电解过程中,H+在阴极上得电子变成H2逸出,使H2O?H++OH-电离平衡向右移动,OH-在阴极区浓度增大,Na+向阴极区移动,最后NaOH在阴极区生成,
故答案为:H+在阴极上得电子变成H2逸出,使H2O?H++OH-电离平衡向右移动,OH-在阴极区浓度增大,Na+向阴极区移动,最后NaOH在阴极区生成.
点评:本题考查了粗盐的提纯、难溶电解质的沉淀平衡及转化、电解原理、离子方程式的书写等知识,题目难度中等,试题涉及的题量较大,知识点较多,注意掌握粗盐的提纯方法、物质的分离与提纯原则,明确电解原理及应用方法,能够正确书写离子方程式.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案
相关题目