题目内容
11.下列说法中,正确的是( )| A. | 浓硫酸稀释时溶液温度升高,说明浓硫酸稀释只有水合过程 | |
| B. | 蔗糖是非电解质,放入水中溶液温度没有明显变化,说明蔗糖溶于水既没有扩散过程也没有水合过程 | |
| C. | 家用石碱(Na2CO3•10H2O)久置后,由块状变成粉末状,这一变化是风化的结果 | |
| D. | 从冰箱中取出物品,表面很快出现水珠,这种现象叫潮解 |
分析 A.物质溶解过程中包括两个过程,一是物质扩散过程需要吸收热量,二是物质水合过程需要放出热量,溶解后溶液温度变化取决于二者相对大小;
B.蔗糖溶解过程中包括物质扩散过程和物质水合过程;
C.结晶水合物在常温时放在干燥的空气里,会逐渐失去结晶水的现象叫风化;
D.冰箱中冷藏的物品温度低,空气中的水蒸汽遇到温度低的物品液化成小水滴.
解答 解:A.物质溶解过程中包括两个过程,一是物质扩散过程需要吸收热量,二是物质水合过程需要放出热量,溶解后溶液温度变化取决于二者相对大小,浓硫酸稀释时溶液温度升高,说明扩散过程吸收热量小于水合过程放出热量,所以溶液温度升高,故A错误;
B.蔗糖溶解过程中包括物质扩散过程和物质水合过程,蔗糖放入水中溶液温度没有明显变化,是因为两个过程中热量变化相当,故B错误;
C.结晶水合物在常温时放在干燥的空气里,会逐渐失去结晶水的现象叫风化,所以家用石碱(Na2CO3•10H2O)久置后,失去结晶水,有块状变成粉末状,这一变化是风化的结果,故C正确;
D.冰箱中冷藏的物品温度低,空气中的水蒸汽遇到温度低的物品液化成小水滴,是一种液化现象,不是潮解,故D错误.
故选C.
点评 本题主要考查了物质溶解过程中的能量变化规律、潮解和风化的概念,题目难度不大,注意知识的积累,侧重于考查学生对基础知识的应用能力.

练习册系列答案
相关题目
1.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如表:
回答下列问题:
(1)加入过量废铁屑的目的是2Fe3++Fe=3Fe2+(用离子方程式表示);加入少量NaHCO3的目的是调节pH,在pH在4.4-7.5之间将铝离子转化为Al(OH)3沉淀,而亚铁离子不能生成沉淀;该工艺中“搅拌”的作用是使反应物充分接触,加快反应速率,使反应充分进行;
(2)反应Ⅱ中的离子方程式为Fe2++2H++NO2-=Fe3++NO↑+H2O;该流程中可以循环、回收利用的物质是NO;
(3)生产中碱式硫酸铁溶液蒸发时需要在减压条件下的原因是碱式硫酸铁受热易分解;
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为A.(填写字母)
A.酸性KMnO4溶液B.KSCN溶液 C.氯水D.NaOH溶液.

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)加入过量废铁屑的目的是2Fe3++Fe=3Fe2+(用离子方程式表示);加入少量NaHCO3的目的是调节pH,在pH在4.4-7.5之间将铝离子转化为Al(OH)3沉淀,而亚铁离子不能生成沉淀;该工艺中“搅拌”的作用是使反应物充分接触,加快反应速率,使反应充分进行;
(2)反应Ⅱ中的离子方程式为Fe2++2H++NO2-=Fe3++NO↑+H2O;该流程中可以循环、回收利用的物质是NO;
(3)生产中碱式硫酸铁溶液蒸发时需要在减压条件下的原因是碱式硫酸铁受热易分解;
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为A.(填写字母)
A.酸性KMnO4溶液B.KSCN溶液 C.氯水D.NaOH溶液.
2.下列关于钠元素的几种表达式错误的是( )
| A. | Na+的电子排布图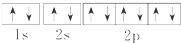 | B. | Na+的结构示意图: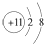 | ||
| C. | Na的电子排布式:1s22s22p63s1 | D. | Na的简化的电子排布式:[Na]3s1 |
19.能清楚地反映甲烷分子里碳、氢原子的大小和相对空间位置的是( )
| A. | 结构式 | B. | 电子式 | C. | 球棍模型 | D. | 分子式 |
6.关于燃料充分利用的说法错误的是( )
| A. | 热能要充分利用 | |
| B. | 燃料充分燃烧时输入的空气量越多越好 | |
| C. | 固体燃料燃烧前要粉碎 | |
| D. | 液体燃料燃烧时可以雾状喷出 |
16.如图为铜锌原电池示意图,下列说法中不正确的是( )
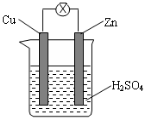

| A. | 锌片逐渐溶解,铜片上有气泡 | B. | 锌片为正极,铜片为负极 | ||
| C. | 电子由锌片通过导线流向铜片 | D. | 该装置能够将化学能转化为电能 |
3.现有部分短周期主族元素的性质或原子结构如表:
(1)元素Y在周期表中的位置第二周期第ⅤA族(周期、族).
(2)XN2的电子式是: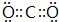 ,Y的简单氢化物的结构式
,Y的简单氢化物的结构式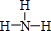 .
.
(3)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4.
(4)用电子式表示WZ的形成过程 .
.
(5)元素Z和T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是B.
A.常温下Z单质和T单质状态不同B.Z的氢化物比T的氢化物稳定
C.一定条件下,Z和T的单质都能与氢氧化钠溶液反应
(6)写出W单质和H2O反应的化学方程式2Na+2H2O=2NaOH+H2↑所得溶液的溶质是离子化合物(填“离子”或“共价”).
| 元素编号 | 元素性质或原子结构 |
| T | M层上有6个电子 |
| W | 短周期内原子半径最大的元素 |
| N | 原子序数比T小,且与T在同一主族 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氨化物的水溶液呈碱性 |
| Z | 元素最高正价为+7价 |
(2)XN2的电子式是:
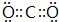 ,Y的简单氢化物的结构式
,Y的简单氢化物的结构式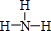 .
.(3)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4.
(4)用电子式表示WZ的形成过程
 .
.(5)元素Z和T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是B.
A.常温下Z单质和T单质状态不同B.Z的氢化物比T的氢化物稳定
C.一定条件下,Z和T的单质都能与氢氧化钠溶液反应
(6)写出W单质和H2O反应的化学方程式2Na+2H2O=2NaOH+H2↑所得溶液的溶质是离子化合物(填“离子”或“共价”).
4.某溶液中的离子只有NH4+、Cl-、H+和OH-四种,下列描述正确的是( )
| A. | 该溶液中的溶质只有NH4Cl | |
| B. | 当溶液呈碱性时:c(NH4+)+c(H+)<c(Cl-)+c(OH-) | |
| C. | 溶液中离子浓度大小关系可能为:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| D. | 该溶液可能由pH=12的氨水与pH=2的HCl溶液等体积混合而成 |