题目内容
盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现已知火箭发射时可用肼(N2H4)为燃料,以NO2作氧化剂,反应生成N2(g)和气态的水,据下列的2个热化学反应方程式:
N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ/mol
试写出气态肼(N2H4)与NO2反应生成N2(g)和气态水的热化学反应方程式: .
N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ/mol
试写出气态肼(N2H4)与NO2反应生成N2(g)和气态水的热化学反应方程式:
考点:热化学方程式
专题:化学反应中的能量变化
分析:依据题干热化学方程式和盖斯定律进行计算得到所需热化学方程式.
解答:
解:①N2(g)+2O2(g)═2NO2(g)△H1=+67.7KJ/mol;
②N2H4(g)+O2(g)═N2(g)+2H2O(g)△H2=-534KJ/mol;
依据盖斯定律②×2-①得到,则肼与NO2完全反应的热化学方程式为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7KJ/mol
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7KJ/mol;
②N2H4(g)+O2(g)═N2(g)+2H2O(g)△H2=-534KJ/mol;
依据盖斯定律②×2-①得到,则肼与NO2完全反应的热化学方程式为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7KJ/mol
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7KJ/mol;
点评:本题考查了热化学方程式的书写方法和盖斯定律的计算应用,题目较简单.

练习册系列答案
相关题目
 如图是周期表中短周期的一部分,X、Y、Z三种元素原子核外电子数之和等于Y的质量数,Y原子核内质子数与中子数相等,下列叙述不正确的是( )
如图是周期表中短周期的一部分,X、Y、Z三种元素原子核外电子数之和等于Y的质量数,Y原子核内质子数与中子数相等,下列叙述不正确的是( )| A、X元素最高价氧化物对应的水化物具有强氧化性和不稳定性 |
| B、Y元素的常见氧化物、气态氢化物的水溶液均是酸 |
| C、Z元素的单质能与水剧烈反应 |
| D、X、Y、Z的最高价含氧酸及气态氢化物的水溶液都是强酸 |
四种短周期元素在周期表中的位置如图,其中只有M为金属元素.下列说法不正确的是( )
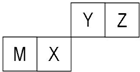

| A、M的离子半径小于Z的离子半径 |
| B、M和Y的最高价氧化物对应水化物之间能相互反应 |
| C、X的单质可以做光导纤维和半导体材料 |
| D、常温下,0.01mol/L的Y的气态氢化物的水溶液的pH=12 |