题目内容
1.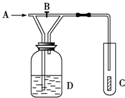 如图,从A处通入纯净的Cl2,打开B阀时,C处的红色布条上看不到明显现象;当关闭B阀后,C处红布逐渐褪色,则D瓶中装的是( )
如图,从A处通入纯净的Cl2,打开B阀时,C处的红色布条上看不到明显现象;当关闭B阀后,C处红布逐渐褪色,则D瓶中装的是( )| A. | 浓H2SO4 | B. | NaOH溶液 | C. | H2O | D. | 饱和NaCl溶液 |
分析 干燥氯气不具有漂白性,次氯酸具有漂白性,打开B阀时,C处的红色布条上看不到明显现象;当关闭B阀后,C处红布逐渐褪色,说明A通入的是干燥的氯气,D中物质不能与氯气反应,且能够提供分,据此解答.
解答 解:A.浓硫酸具有吸水性,不能提供水分子,故A不选;
B.氢氧化钠溶液能够与氯气反应,故B不选;
C.氯气通入水,携带出水蒸汽,氯气与水反应生成次氯酸具有漂白性,符合题意,故C选;
D.饱和食盐水中含有水,且与水不反应,氯气与水反应生成次氯酸具有漂白性,符合题意,故D选;
故选:CD.
点评 本题考查氯气的化学性质,明确装置中D瓶的作用是解答本题的关键,注意干燥的氯气不具有漂白性,题目难度不大.

练习册系列答案
相关题目
11.用有阳离子交换膜(只允许阳离子通过)的电解槽电解食盐水时,以下叙述错误的是( )
| A. | 用铁作阴极 | B. | 用碳棒作正极 | ||
| C. | 食盐水从阳极区加入 | D. | 烧碱溶液从阴极区流出 |
9.分枝酸结构简式如图,下列说法正确的是( )
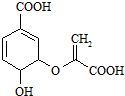

| A. | 分子式为C10H8O6 | |
| B. | 分子中含有2种官能团 | |
| C. | 可与乙醇、乙酸反应,且反应类型相同 | |
| D. | 1mol分枝酸最多可与3mol NaOH发生中和反应 |
6.下表是元素周期表的一部分,针对所给的10种元素,完成下列各小题.
(1)化学性质最不活泼的元素是氩(填元素名称);
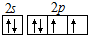
(2)N原子结构示意图为 ;Ca的最外层电子数为2.
;Ca的最外层电子数为2.
(3)第3周期元素中,最高价氧化物对应水化物酸性最强的是HClO4(填化学式);
(4)C、N和O原子半径由小到大的顺序的是O<N<C;
(5)第2周期中气态氢化物最稳定的是H2O;(填化学式);
(6)Si是带来人类文明的重要元素之一,晶体硅的主要用途是集成电路、半导体等(写出一种).
(7)海洋是大自然赐予人类的宝物.从中可以提取的第一大类物质是NaCl该物质的焰色反应为黄色,它暴露在空气中易潮解是因为还含有MgCl2.
(8)Na、Al最高价氧化物的水化物之间反应的化学方程式是NaOH+Al(OH)3=NaAlO2+2H2O.
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | C | N | O | |||||
| 3 | Na | Mg | Si | S | Cl | Ar | ||
| 4 | Ca |
(2)N原子结构示意图为
 ;Ca的最外层电子数为2.
;Ca的最外层电子数为2.(3)第3周期元素中,最高价氧化物对应水化物酸性最强的是HClO4(填化学式);
(4)C、N和O原子半径由小到大的顺序的是O<N<C;
(5)第2周期中气态氢化物最稳定的是H2O;(填化学式);
(6)Si是带来人类文明的重要元素之一,晶体硅的主要用途是集成电路、半导体等(写出一种).
(7)海洋是大自然赐予人类的宝物.从中可以提取的第一大类物质是NaCl该物质的焰色反应为黄色,它暴露在空气中易潮解是因为还含有MgCl2.
(8)Na、Al最高价氧化物的水化物之间反应的化学方程式是NaOH+Al(OH)3=NaAlO2+2H2O.
13.如图是可逆反应A+2B?2C+3D的反应速率随反应时间变化的示意图,由此可推断( )
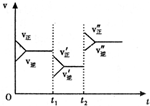

| A. | t1时若是降温使速率变化,则正确反应是放热反应 | |
| B. | t2时若是加压使速度变化,则A、B、C、D均为气体 | |
| C. | t2时改变的条件可能是加入催化剂 | |
| D. | t2时改变的条件可能是增大反应物的浓度 |
10.常温下,下列溶液中各离子浓度关系正确的是( )
| A. | 浓度为0.1 mol•L-1的碳酸钠溶液:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | pH=12的氨水溶液与pH=2的盐酸等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 等物质的量的氨水和盐酸混合后的溶液:c(H+)=c(OH-)+c(NH3•H2O) | |
| D. | 醋酸溶液与NaOH溶液相混合后,所得溶液呈中性:c(Na+)>c(CH3COO-) |
11.已知酸性溶液中还原性的顺序为SO32->I->Fe2+>Br->Cl-,下列反应不能发生的是( )
| A. | 2Fe3++SO32-+H2O→2Fe2++SO42-+2H+ | |
| B. | I2+SO32-+H2O→SO42-+2I-+2H+ | |
| C. | 2Fe2++I2→2Fe3++2I- | |
| D. | Br2+SO32-+H2O→SO42-+2Br-+2H+ |
 .
. .
.