题目内容
汽车上的催化转化器可将尾气中的主要污染物转化成无毒物质,反应为:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-a kJ/mol(a>0)
在某温度时,用气体传感器测得不同时间的NO和CO浓度如下表:
经分析,得出结论不正确的是( )
在某温度时,用气体传感器测得不同时间的NO和CO浓度如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/10-4mol?L-1 | 10.0 | 4.05 | 2.50 | 1.60 | 1.00 | 1.00 |
| c(CO)/10-3mol?L-1 | 3.60 | 3.05 | 2.85 | 2.76 | 2.70 | 2.70 |
| A、2~3s间的平均反应速率v(NO)=9×10-5mol/(L?s) |
| B、催化转化器对废气的转化速率在夏季时比冬季时高 |
| C、若该催化转化器气舱容积为2L,则达到平衡时反应放出热量1.8a J |
| D、该温度下,此反应的平衡常数K=5000 |
考点:化学平衡的计算
专题:化学平衡专题
分析:该反应的正反应为放热反应,升高温度不利于平衡向正向移动,反应速率较快,可适用于废气的处理,计算出平衡时各物质的浓度,结合平衡常数表达式可计算平衡常数,以此解答该题.
解答:
解:A.2s-3s内的平均反应速率v(NO)=
×10-4=9×10-5mol?L-1?S1,故A正确;
B.升高温度增大反应速率,转化速率在夏季时比冬季时高,故B正确;
C.4s时反应达到平衡状态,消耗一氧化碳物质的量=(3.6mol/L-2.70mol/L)×2L=1.8mol,依据热化学方程式计算可知,2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-a kJ/mol,则达到平衡时反应放出热量0.9a KJ,故C错误;
D.2NO(g)+2CO(g)=N2(g)+2CO2(g)
初始浓度:10×10-4 3.6×10-3 0 0
变化浓度:9×10-4 9×10-4 4.5×10-4 9×10-4
平衡浓度:1×10-4 2.7×10-3 4.5×10-4 9×10-4
K=
=5000,故D正确.
故选C.
| 2.5mol/L-1.6mol/L |
| 3s-2s |
B.升高温度增大反应速率,转化速率在夏季时比冬季时高,故B正确;
C.4s时反应达到平衡状态,消耗一氧化碳物质的量=(3.6mol/L-2.70mol/L)×2L=1.8mol,依据热化学方程式计算可知,2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-a kJ/mol,则达到平衡时反应放出热量0.9a KJ,故C错误;
D.2NO(g)+2CO(g)=N2(g)+2CO2(g)
初始浓度:10×10-4 3.6×10-3 0 0
变化浓度:9×10-4 9×10-4 4.5×10-4 9×10-4
平衡浓度:1×10-4 2.7×10-3 4.5×10-4 9×10-4
K=
| 4.5×10-4×(9×10-4)2 |
| (1×10-4)2×(2.7×10-3)2 |
故选C.
点评:本题考查化学平衡的调控作用,侧重于学生的分析能力和计算能力的考查,为高考常见题型和高频考点,注意把握反应的特点以及影响因素的判断,易错点为C,题目难度中等.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
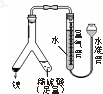 用如图所示实验装置测定某温度下气体摩尔体积,有关叙述错误的是( )
用如图所示实验装置测定某温度下气体摩尔体积,有关叙述错误的是( )| A、将水准管上提,液面高于量气管且不下降,说明装置不漏气 |
| B、可用来测定镁的相对原子质量 |
| C、读取气体体积时水准管的水面高于量气管的水面,可导致测定结果偏高 |
| D、金属镁中含有少量杂质铝,可导致测定结果偏高 |
下列做法中,不利于实现让定州“天更蓝,水更清”目标的是( )
| A、推广使用无磷洗涤剂 |
| B、推广使用脱硫煤 |
| C、减少汽车尾气排放 |
| D、任意排放污水 |
有A、B两种混合粉末,质量分别为m1、m2.A由CaCO3和KHCO3组成,B由MgCO3和NaHCO3组成.将A、B分别与足量稀盐酸反应,生成二氧化碳气体的质量均为wg.下列说法正确的是( )(已知:KHCO3+HCl→KCl+CO2↑+H2O,NaHCO3+HCl→NaCl+CO2↑+H2O)
| A、m1=m2 |
| B、混合物A中CaCO3和KHCO3质量比一定为1:1 |
| C、25m1=21m2 |
| D、混合物B中MgCO3和NaHCO3质量比可为任意比 |