题目内容
利用化石燃料开采、加工过程产生的H2S废气制取氢气,既廉价又环保.
利用H2S废气制取氢气来的方法有多种
(1)高温热分解法
已知:H2S(g)?H2(g)+
S2(g)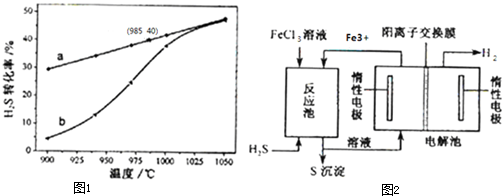
在恒温密闭容器中,控制不同温度进行H2S分解实验.以H2S起始浓度均为0.2mol?L-1测定H2S的转化率,结果见图1.图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率.据图计算985℃时H2S按上述反应分解的平衡常数K= ;说明温度的升高,曲线b向曲线a逼近的原因: .
(2)电化学法
该法制氢过程的示意图如图2.反应池中反应物的流向采用气、液逆流方式,其目的是 ;反应池中发生反应的化学方程式为 .反应后的溶液进入电解池,电解总反应的离子方程式为 .
利用H2S废气制取氢气来的方法有多种
(1)高温热分解法
已知:H2S(g)?H2(g)+
| 1 |
| 2 |

在恒温密闭容器中,控制不同温度进行H2S分解实验.以H2S起始浓度均为0.2mol?L-1测定H2S的转化率,结果见图1.图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率.据图计算985℃时H2S按上述反应分解的平衡常数K=
(2)电化学法
该法制氢过程的示意图如图2.反应池中反应物的流向采用气、液逆流方式,其目的是
考点:化学平衡的计算,电解原理
专题:基本概念与基本理论
分析:(1)K为生成物浓度幂之积与反应物浓度幂之积的比;温度的升高,曲线b向曲线a逼近,反应速率加快;
(2)反应池中反应物的流向采用气、液逆流方式,可增大反应物接触面积;反应池中发生氧化还原反应;电解池中亚铁离子失去电子,氢离子得到电子,以此来解答.
(2)反应池中反应物的流向采用气、液逆流方式,可增大反应物接触面积;反应池中发生氧化还原反应;电解池中亚铁离子失去电子,氢离子得到电子,以此来解答.
解答:
解:(1)以H2S起始浓度均为0.2mol?L-1测定H2S的转化率,985℃时H2S的转化率为40%,则
H2S(g)?H2(g)+
S2(g)
开始(mol?L-1 ) 0.2 0 0
转化(mol?L-1 ) 0.08 0.08 0.04
平衡(mol?L-1 ) 0.12 0.08 0.04
K=
=0.13;
温度的升高,曲线b向曲线a逼近,反应速率加快,达到平衡时的时间缩短,
故答案为:0.13;温度升高,反应速率加快,达到平衡所需的进间缩短;
(2)反应池中反应物的流向采用气、液逆流方式,可增大反应物接触面积;反应池中发生氧化还原反应为H2S+2FeCl3=2FeCl2+S↓+2HCl;电解池中亚铁离子失去电子,氢离子得到电子,电解总反应的离子方程式为2Fe2++2H+
2Fe3++H2↑,
故答案为:增大反应物接触面积,使反应更充分;H2S+2FeCl3=2FeCl2+S↓+2HCl;2Fe2++2H+
2Fe3++H2↑.
H2S(g)?H2(g)+
| 1 |
| 2 |
开始(mol?L-1 ) 0.2 0 0
转化(mol?L-1 ) 0.08 0.08 0.04
平衡(mol?L-1 ) 0.12 0.08 0.04
K=
0.08×0.04
| ||
| 0.12 |
温度的升高,曲线b向曲线a逼近,反应速率加快,达到平衡时的时间缩短,
故答案为:0.13;温度升高,反应速率加快,达到平衡所需的进间缩短;
(2)反应池中反应物的流向采用气、液逆流方式,可增大反应物接触面积;反应池中发生氧化还原反应为H2S+2FeCl3=2FeCl2+S↓+2HCl;电解池中亚铁离子失去电子,氢离子得到电子,电解总反应的离子方程式为2Fe2++2H+
| ||
故答案为:增大反应物接触面积,使反应更充分;H2S+2FeCl3=2FeCl2+S↓+2HCl;2Fe2++2H+
| ||
点评:本题以硫化氢为载体考查物质的性质、影响反应速率的因素、化学平衡常数计算等,题目综合性强,难度较大,注重了高考常考考点的考查,注意知识的迁移应用和信息的处理.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
在可逆反应2A(g)+3B(g)?xC(g)+D(g)中,已知:反应开始加入的物质只有A、B,起始浓度A为5mol?L-1,B为3mol?L-1,前2min内C的平均反应速率为0.5mol?L-1?min-1.2min后,测得D的浓度为0.5mol?L-1.则关于此反应的下列说法中正确的是( )
| A、2 min末时A和B的浓度之比为5:3 |
| B、x=2 |
| C、2 min末时B的浓度为1.5 mol?L-1 |
| D、2 min末时A的消耗浓度为0.5 mol?L-1 |
1998年出现的全球温度大幅度升高,产生了显著的“厄尓尼诺”现象,干旱和暴雨危害了许多地区.为了防止气候进一步变暖,联合国环境保护组织要求各国减少工业排放量的气体是( )
| A、SO2 |
| B、H2S |
| C、SO3 |
| D、CO2 |
下列物质转化在给定条件下能实现的是( )
①Al2O3
NaAlO2(aq)
Al(OH)3
②S
SO3
H2SO4
③饱和NaCl(aq)
NaHCO3
Na2CO3
④MgCl2(aq)
Mg(OH)2
MgO
⑤Cl2
FeCl3
FeCl2.
①Al2O3
| NaOH(aq) |
| △ |
| CO2 |
②S
| O2/点燃 |
| H2O |
③饱和NaCl(aq)
| NH3CO3 |
| △ |
④MgCl2(aq)
| 石灰乳 |
| 燃烧 |
⑤Cl2
| Fe |
| Fe |
| A、①③④⑤ | B、②③④ |
| C、①②④ | D、①②③④⑤ |
 2006年6月5日是第35个世界环境日,我国环保总局确定的主题见图.下列措施不符合这一主题的是( )
2006年6月5日是第35个世界环境日,我国环保总局确定的主题见图.下列措施不符合这一主题的是( )| A、用“绿色化学”工艺,使原料尽可能转化为所需的物质 |
| B、回收废电池,减少对环境的污染 |
| C、为使农作物高产,大量施用化肥和农药 |
| D、推广垃圾分类存放,分类回收,分类处理 |
汽车上的催化转化器可将尾气中的主要污染物转化成无毒物质,反应为:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-a kJ/mol(a>0)
在某温度时,用气体传感器测得不同时间的NO和CO浓度如下表:
经分析,得出结论不正确的是( )
在某温度时,用气体传感器测得不同时间的NO和CO浓度如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/10-4mol?L-1 | 10.0 | 4.05 | 2.50 | 1.60 | 1.00 | 1.00 |
| c(CO)/10-3mol?L-1 | 3.60 | 3.05 | 2.85 | 2.76 | 2.70 | 2.70 |
| A、2~3s间的平均反应速率v(NO)=9×10-5mol/(L?s) |
| B、催化转化器对废气的转化速率在夏季时比冬季时高 |
| C、若该催化转化器气舱容积为2L,则达到平衡时反应放出热量1.8a J |
| D、该温度下,此反应的平衡常数K=5000 |
一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合如图的是( )

| A、2C6H5CH2CH3(g)+O2(g)?2C6H5CH=CH2(g)+2H2O(g)△H<0 |
| B、CO2(g)+H2(g)?CO(g)+H2O(g)△H>0 |
| C、CH3CH2OH(g)?CH2=CH2(g)+H2O(g)△H>0 |
| D、CO2(g)+2NH3(g)?CO(NH2)2(s)+H2O(g)△H<0 |
下列叙述正确的是( )
| A、往待测液中滴加氯水,然后滴加KSCN溶液,以检测待测液中是否含有Fe2+ |
| B、往待测液中滴加BaCl2,然后滴加盐酸,以检测待测液中是否含有SO42- |
| C、蒸馏操作时应将温度计的水银球插入液面下 |
| D、向试管中加入5mL SO2水溶液,然后滴加BaCl2溶液,再滴加3%的H2O2溶液,以检测SO2具有还原性 |