题目内容
(1)为解决能源问题,有科学家提出“种植石油”的设想,通过大量种植含油量较高的植物来获取可燃油料,这种油的成份可能是 .
A、柴油 B、甘油 C、高级脂肪甘油酯 D、甲醇
(2)为了减少煤燃烧时造成的环境污染,人们设法将煤转化成清洁的燃料.例如煤的气化和液化就是使煤变成清洁能源的有效途径.煤的气化主要化学反应是煤和水蒸气的反应.反应方程式为: .煤的液化是把煤气化后得到的一氧化碳和氢气,在一定条件下合成甲醇,其反应方程式为: .
A、柴油 B、甘油 C、高级脂肪甘油酯 D、甲醇
(2)为了减少煤燃烧时造成的环境污染,人们设法将煤转化成清洁的燃料.例如煤的气化和液化就是使煤变成清洁能源的有效途径.煤的气化主要化学反应是煤和水蒸气的反应.反应方程式为:
考点:常见的生活环境的污染及治理,清洁能源
专题:化学应用
分析:(1)含油量较高的植物中的植物油属于酯类,据此回答判断;
(2)煤和水蒸气的反应生成一氧化碳和氢气;一氧化碳和氢气,在一定条件下合成甲醇,据此书写方程式.
(2)煤和水蒸气的反应生成一氧化碳和氢气;一氧化碳和氢气,在一定条件下合成甲醇,据此书写方程式.
解答:
解:(1)含油量较高的植物中的植物油属于酯类,成分是高级脂肪甘油酯,故选C;
(2)水和煤之间的反应为:C+H2O(g)
CO+H2,一氧化碳和氢气在一定条件下合成甲醇的原理为:CO+2H2
CH3OH;
故答案为:C+H2O(g)
CO+H2;CO+2H2
CH3OH.
(2)水和煤之间的反应为:C+H2O(g)
| ||
| ||
故答案为:C+H2O(g)
| ||
| ||
点评:本题是一道关于化学的应用方面的知识题目,考查学生的信息的应用能力,难度不大.

练习册系列答案
相关题目
工业上用铝土矿(主要成分为Al2O3,含SiO2、Fe2O3等杂质)为原料冶炼铝的工艺流程如下,对下述流程中的判断正确的是( )
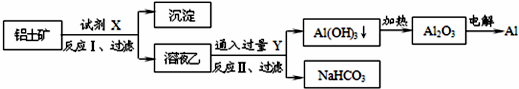

| A、试剂X为稀硫酸,沉淀中含有硅的化合物 |
| B、反应II中生成Al(OH)3的反应为:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- |
| C、结合质子(H+)的能力由弱到强的顺序是OH->CO32->AlO2- |
| D、Al2O3熔点很高,工业上还可采用电解熔融AlCl3冶炼Al |
下列物质转化在给定条件下能实现的是( )
①Al2O3
NaAlO2(aq)
Al(OH)3
②S
SO3
H2SO4
③饱和NaCl(aq)
NaHCO3
Na2CO3
④MgCl2(aq)
Mg(OH)2
MgO
⑤Cl2
FeCl3
FeCl2.
①Al2O3
| NaOH(aq) |
| △ |
| CO2 |
②S
| O2/点燃 |
| H2O |
③饱和NaCl(aq)
| NH3CO3 |
| △ |
④MgCl2(aq)
| 石灰乳 |
| 燃烧 |
⑤Cl2
| Fe |
| Fe |
| A、①③④⑤ | B、②③④ |
| C、①②④ | D、①②③④⑤ |
汽车上的催化转化器可将尾气中的主要污染物转化成无毒物质,反应为:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-a kJ/mol(a>0)
在某温度时,用气体传感器测得不同时间的NO和CO浓度如下表:
经分析,得出结论不正确的是( )
在某温度时,用气体传感器测得不同时间的NO和CO浓度如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/10-4mol?L-1 | 10.0 | 4.05 | 2.50 | 1.60 | 1.00 | 1.00 |
| c(CO)/10-3mol?L-1 | 3.60 | 3.05 | 2.85 | 2.76 | 2.70 | 2.70 |
| A、2~3s间的平均反应速率v(NO)=9×10-5mol/(L?s) |
| B、催化转化器对废气的转化速率在夏季时比冬季时高 |
| C、若该催化转化器气舱容积为2L,则达到平衡时反应放出热量1.8a J |
| D、该温度下,此反应的平衡常数K=5000 |
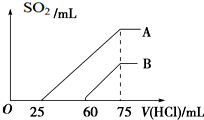 向浓度相等、体积均为50mL的A、B两份KOH溶液中,分别通入一定量的SO2气体后,再稀释到100mL.
向浓度相等、体积均为50mL的A、B两份KOH溶液中,分别通入一定量的SO2气体后,再稀释到100mL.
 高炉炼铁过程中发生的主要反应为
高炉炼铁过程中发生的主要反应为