题目内容
18.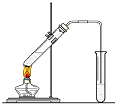 在实验室我们用如图所示的装置制取乙酸乙酯.回答下列问题:
在实验室我们用如图所示的装置制取乙酸乙酯.回答下列问题:(1)写出制取乙酸乙酯的化学反应方程式CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O;
(2饱和碳酸钠溶液的主要作用是降低酯在其中的溶解度,有利于酯分离;除去粗产品中的乙酸和乙醇.
(3)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防倒吸.
(4)若要把制得的乙酸乙酯分离出来,应采用的实验操作是分液.
(5)30g乙酸与46g乙醇反应,如果实际产率是理论产率的60%,则可得到的乙酸乙酯的质量是26.4g.
分析 (1)实验室用乙酸和乙醇反应制取乙酸乙酯,依据酯化反应的反应历程是羧酸脱羟基醇脱氢书写;
(2)饱和食盐水中,降低了乙酸乙酯的溶解度,同时还能除去混有的乙醇和乙酸;
(3)通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中防止吸收液倒吸;
(4)分离互不相溶的液体的操作是分液;
(5)先判断两种反应物谁过量,按不足量来计算.
解答 解:(1)乙酸和乙醇反应制取乙酸乙酯,发生反应的方程式为:CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O;
故答案是:CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O;
(2)制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,目的是除去乙醇和乙酸、降低乙酸乙酯的溶解度,产物便于分层,
故答案是:降低酯在其中的溶解度,有利于酯分离;除去粗产品中的乙酸和乙醇;
(3)导管不能插入溶液中,防止饱和碳酸钠溶液吸入反应试管中,
故答案是:防倒吸;
(4)乙酸乙酯不溶于水,可以采用分液操作,分离乙酸乙酯;
故答案是:分液;
(5)30乙酸的物质的量为:30g÷60g/mol═0.5mol,46g乙醇的物质的量为1mol,根据方程式:CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O,应按乙酸完全反应来计算理论产生乙酸乙酯的量为0.5mol,质量为0.5mol×88g/mol=44g,实际产量为0.44g×60%=26.4g,
故答案为:26.4g.
点评 本题考查乙酸乙酯的制备、有关化学方程式的简单计算,题目难度中等,注意实验的基本操作以及饱和碳酸钠溶液的作用,根据化学方程式的计算是易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.下列离子方程式书写正确的是( )
| A. | 向稀硫酸中滴加NaOH:2H++2OH-═2H2O | |
| B. | 向A1C13溶液中加入氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| C. | 向BaCl2溶液通入CO2:Ba2++CO2+H2O═BaCO3↓+2 H+ | |
| D. | 硫酸与氢氧化钡溶液反应:H++OH-+LV+Ba2++SO42-═BaSO4↓+H2O |
17.已知SO32-+I2+H2O=SO42-+2I-+2H+.某溶液中可能含有I-、NH4+、Cu2+、SO32-,向该无色溶液中加入少量溴水,溶液仍呈无色.则下列关于该溶液组成的判断正确的是( )
| A. | 肯定不含I- | B. | 可能含有Cu2+ | C. | 一定含有SO32- | D. | 肯定不含有NH4+ |
6. 乙酸正丁酯常用作香精,实验室用冰醋酸和正丁醇制备乙酸正丁酯
乙酸正丁酯常用作香精,实验室用冰醋酸和正丁醇制备乙酸正丁酯
Ⅰ.乙酸正丁酯粗产品的制备
试管中加少许入沸石、7.4 mL正丁醇和6.4 mL冰醋酸,再加入3~4滴浓硫酸,然后安装好装置,加热使之反应.
Ⅱ.乙酸正丁酯粗产品的精制
将试管中的液体转移到分液漏斗中,用10 mL水洗涤,除去下层水层;有机层继续用10 mL 10% Na2CO3洗涤至中性;再用10 mL 的水洗涤.
将酯层进行蒸馏.蒸馏收集乙酸正丁酯产品时,应将温度控制在126.1℃左右.
Ⅲ.计算产率
称量出制得的乙酸正丁酯的质量为5.12 g.
已知:
完成下列填空:
(1)如图装置中长导管有冷凝回流作用,它可以由分水回流装置代替.分水回流装置中回流下来的蒸气冷凝液进入分水器,待分层后,有机层会自动流回到反应器中,将生成的水从分水器中放出去.
分水回流代替长导管回流,对乙酸正丁酯的合成有什么作用.可逆反应,水移离反应体系,平衡向生成酯的方向移动,产率提高
使用分水器装置进行回流的可逆反应反应,一般应具备条件.有水生成,回流有机物位于水上层(反应温度100℃左右)
(2)分水器在使用时须预先加水,使其水面低于分水器回流支管下沿3~5 mm的水.
预先加水的目的是.回流的有机物能及时返回反应体系
(3)反应时加热有利于提高酯的产率,但温度过高时酯的产率反而降低,其可能的原因是.乙酸、正丁醇大量挥发,发生副反应.
(4)水洗的目的是.除去水溶性杂质碱洗的目的是.除去酸性杂质测pH值的操作.pH试纸放在表而皿上,用蘸有待测溶液的玻璃棒点在试纸的中部,与比色卡对照读取pH值.
(5)本次实验乙酸正丁酯的产率.54.5%.
 乙酸正丁酯常用作香精,实验室用冰醋酸和正丁醇制备乙酸正丁酯
乙酸正丁酯常用作香精,实验室用冰醋酸和正丁醇制备乙酸正丁酯Ⅰ.乙酸正丁酯粗产品的制备
试管中加少许入沸石、7.4 mL正丁醇和6.4 mL冰醋酸,再加入3~4滴浓硫酸,然后安装好装置,加热使之反应.
Ⅱ.乙酸正丁酯粗产品的精制
将试管中的液体转移到分液漏斗中,用10 mL水洗涤,除去下层水层;有机层继续用10 mL 10% Na2CO3洗涤至中性;再用10 mL 的水洗涤.
将酯层进行蒸馏.蒸馏收集乙酸正丁酯产品时,应将温度控制在126.1℃左右.
Ⅲ.计算产率
称量出制得的乙酸正丁酯的质量为5.12 g.
已知:
| 物质 | 密度/g•cm-3 | 沸点/℃ | 溶解度/100g水 |
| 正丁醇 | 0.810 | 118.0 | 9 |
| 冰醋酸 | 1.049 | 118.1 | 互溶 |
| 乙酸正丁酯 | 0.882 | 126.1 | 0.7 |
(1)如图装置中长导管有冷凝回流作用,它可以由分水回流装置代替.分水回流装置中回流下来的蒸气冷凝液进入分水器,待分层后,有机层会自动流回到反应器中,将生成的水从分水器中放出去.
分水回流代替长导管回流,对乙酸正丁酯的合成有什么作用.可逆反应,水移离反应体系,平衡向生成酯的方向移动,产率提高
使用分水器装置进行回流的可逆反应反应,一般应具备条件.有水生成,回流有机物位于水上层(反应温度100℃左右)
(2)分水器在使用时须预先加水,使其水面低于分水器回流支管下沿3~5 mm的水.
预先加水的目的是.回流的有机物能及时返回反应体系
(3)反应时加热有利于提高酯的产率,但温度过高时酯的产率反而降低,其可能的原因是.乙酸、正丁醇大量挥发,发生副反应.
(4)水洗的目的是.除去水溶性杂质碱洗的目的是.除去酸性杂质测pH值的操作.pH试纸放在表而皿上,用蘸有待测溶液的玻璃棒点在试纸的中部,与比色卡对照读取pH值.
(5)本次实验乙酸正丁酯的产率.54.5%.
8.中和热是( )
| A. | 酸和碱反应生成1mol水时所放出的热 | |
| B. | 1mol酸和1mol碱反应生成盐和水时所放出的热 | |
| C. | 强酸稀溶液和强碱稀溶液反应生成1mol液态水时所放出的热 | |
| D. | 稀Ba(OH)2和稀H2SO4完全反应生成1mol水时所放出的热 |


 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物加热,并通入水蒸气,就可以完成“高温下,Fe与水蒸气的反应实验”.
应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物加热,并通入水蒸气,就可以完成“高温下,Fe与水蒸气的反应实验”.