题目内容
某同学对MnO2、CuO、Fe2O3、Cr2O3在氯酸钾受热分解反应中的催化作用进行了研究.实验所得数据如下表.就本实验的有关问题,请填空:
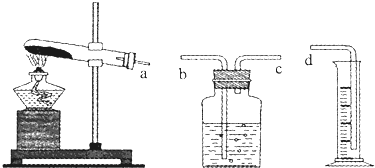
(1)本实验的装置由如图三部分组成,其正确的接口连接顺序为 .
(2)为证明编号2的实验中MnO2起到催化作用,还要测定反应剩余物中MnO2的质量,实验的操作顺序是:溶解→ .
(3)写出实验室中通过编号2制取氧气的化学方程式:
(4)从上表实验数据分析,对氯酸钾受热分解有催化作用的物质,按其催化能力从大到小的顺序为 (填物质的化学式).
(5)在进行编号5的实验时,有刺激性的黄绿色气体产生,该气体可能是 (填化学式),可用 试纸检验该气体,上述异常现象产生的原因是 .
| 实验编号 | KClO3 | 氧化物 | 产生气体(mL)(已折算为标况) | 耗时(s) | ||
| 化学式 | 质量(g) | 实际回收 | ||||
| 1 | 0.6 | - | - | - | 10 | 480 |
| 2 | 0.6 | MnO2 | 0.20 | 90% | 67.2 | 36.5 |
| 3 | 0.6 | CuO | 0.20 | 90% | 67.2 | 79.5 |
| 4 | 0.6 | Fe2O3 | 0.20 | 90% | 6 7.2 | 34.7 |
| 5 | 0.6 | Cr2O3 | 0.20 | 异常 | 67.2 | 188.3 |

(2)为证明编号2的实验中MnO2起到催化作用,还要测定反应剩余物中MnO2的质量,实验的操作顺序是:溶解→
(3)写出实验室中通过编号2制取氧气的化学方程式:
(4)从上表实验数据分析,对氯酸钾受热分解有催化作用的物质,按其催化能力从大到小的顺序为
(5)在进行编号5的实验时,有刺激性的黄绿色气体产生,该气体可能是
考点:催化剂的作用
专题:实验探究和数据处理题
分析:(1)根据排水法测气体体积的进气方式为:短管进气长管出水;
(2)MnO2难溶于水,测定反应剩余物MnO2的质量,要溶解、过滤、洗涤、干燥、称量;
(3)编号2的反应是通过KClO3的受热分解制氧气;
(4)根据生成相同体积氧气时所用时间的长短判断;
(5)根据元素守恒及题意判断生成物,氯气有氧化性,能使湿润的淀粉碘化钾变蓝.
(2)MnO2难溶于水,测定反应剩余物MnO2的质量,要溶解、过滤、洗涤、干燥、称量;
(3)编号2的反应是通过KClO3的受热分解制氧气;
(4)根据生成相同体积氧气时所用时间的长短判断;
(5)根据元素守恒及题意判断生成物,氯气有氧化性,能使湿润的淀粉碘化钾变蓝.
解答:
解:(1)根据排水法测气体体积的进气方式为:短管进气长管出水,所用连接顺序为a→c→b→d,故答案为:a→c→b→d;
(2)MnO2难溶于水,测定反应剩余物MnO2的质量,要溶解、过滤、洗涤、干燥、称量,故答案为:过滤→洗涤→干燥→称量;
(3)编号2的反应是通过KClO3的受热分解制氧气,故化学方程式为:2KClO3
2KCl+3O2↑,故答案为:2KClO3
2KCl+3O2↑;
(4)根据生成相同体积氧气时所用时间的长短,Fe2O3作催化剂用时最短,MnO2作催化剂用时次之,CuO作催化剂用时最长,所以其催化能力从大到小的顺序为:Fe2O3 >MnO2 >CuO,故答案为:Fe2O3 >MnO2 >CuO;
(5)用Cr2O3做研究实验时,发现有刺激性气味的气体产生,同时绿色的混合物变成了橘黄色,则Cr元素的化合价升高,Cl元素的化合价降低,氯酸钾在加热条件下将Cr2O3氧化为可溶性化合物,同时生成氯气,其化学式为Cl2,氯气能使湿润的淀粉碘化钾试纸变蓝,则可以使用湿润的淀粉碘化钾试纸检验氯气,
故答案为:Cl2;湿润的淀粉碘化钾;氯酸钾在加热条件下将Cr2O3氧化为可溶性化合物,并生成氯气.
(2)MnO2难溶于水,测定反应剩余物MnO2的质量,要溶解、过滤、洗涤、干燥、称量,故答案为:过滤→洗涤→干燥→称量;
(3)编号2的反应是通过KClO3的受热分解制氧气,故化学方程式为:2KClO3
| ||
| △ |
| ||
| △ |
(4)根据生成相同体积氧气时所用时间的长短,Fe2O3作催化剂用时最短,MnO2作催化剂用时次之,CuO作催化剂用时最长,所以其催化能力从大到小的顺序为:Fe2O3 >MnO2 >CuO,故答案为:Fe2O3 >MnO2 >CuO;
(5)用Cr2O3做研究实验时,发现有刺激性气味的气体产生,同时绿色的混合物变成了橘黄色,则Cr元素的化合价升高,Cl元素的化合价降低,氯酸钾在加热条件下将Cr2O3氧化为可溶性化合物,同时生成氯气,其化学式为Cl2,氯气能使湿润的淀粉碘化钾试纸变蓝,则可以使用湿润的淀粉碘化钾试纸检验氯气,
故答案为:Cl2;湿润的淀粉碘化钾;氯酸钾在加热条件下将Cr2O3氧化为可溶性化合物,并生成氯气.
点评:本题考查化学反应速率影响的因素,探究催化剂对化学反应速率的影响及催化效果,注意实验过程及实验现象、结论,能够较好的考查学生综合应用知识的能力.

练习册系列答案
相关题目
温度为500℃时,反应4NH3+5O2?4NO+6H2O在5L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率v (x)为( )
| A、v(NO)=0.08mol/(L?s) |
| B、v(O2)=0.01mol/(L?s) |
| C、v(NH3)=0.002mol/(L?s) |
| D、v(H2O)=0.004mol/(L?s) |