题目内容
硫化氢(H2S)分子中,两个H-S键的夹角接近90°,说明H2S分子的空间构型为 ;二氧化碳(CO2)分子中,两个C=O键的夹角是180°,说明CO2分子的空间构型为 ;甲烷(CH4)分子中,两个相邻C-H键的夹角是109.5°,说明CH4分子的空间构型为 .
考点:判断简单分子或离子的构型
专题:化学键与晶体结构
分析:键角是描述共价键分子空间立体结构的重要参数,键角反映了分子中原子在空间的伸展方向,分子构型是由键角决定的.
解答:
解:H2S分子中共价键键角接近90°,即H-S-S键角接近90°,空间构型为V形;CO2分子中的共价键键角为180°,O=C=O键角为180°,形成直线,分子构型为直线形;甲烷(CH4)分子中,两个相邻C-H键的夹角是109.5°,C原子位于中心,四个氢原子为顶点,四个H原子与一个C原子形成正四面体形,
故答案为:V形;直线形;正四面体.
故答案为:V形;直线形;正四面体.
点评:本题考查了分子的空间构型,把握常见分子的空间构型和键角,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列实验操作正确的是( )
| A、过滤时,倾倒液体用玻璃棒引流 |
| B、用剩的药品放回原瓶 |
| C、用细口瓶盛放固体药品 |
| D、用托盘天平称量药品时,左盘放砝码,右盘放药品 |
下列有关实验的说法不正确的是( )
| A、取用液溴时,应戴上橡皮手套 |
| B、配制一定物质的量浓度的NaCl溶液时,NaCl应在烧杯中溶解 |
| C、加热乙酸、乙醇、浓硫酸的混合物制备乙酸乙酯时,应加入2~3块碎瓷片 |
| D、无色溶液中滴加硝酸酸化的BaCl2溶液,产生白色沉淀,则溶液中一定含有SO42- |
下列各组单质中,前者能将后者从化合物中置换出来的是( )
①Al、Fe ②Mg、C ③H2、Cu.
①Al、Fe ②Mg、C ③H2、Cu.
| A、只有①③ | B、只有② |
| C、①②③ | D、只有①② |
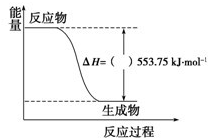 (1)许多运动会使用的火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题:
(1)许多运动会使用的火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题: