题目内容
20.某溶液中可能含有下列5种离子中的某几种:Na+、NH4+、Fe3+、Al3+、Clˉ.为确认该溶液组成进行如下实验:①取20.0mL该溶液,加入20.0mL 4.00mol•L-1NaOH溶液,生成红褐色沉淀且没有刺激性气体生成.将沉淀过滤、洗涤、灼烧,得固体0.80g.再将滤液稀释至100mL,测得滤液中c(OHˉ)为0.10mol•L-1;
②另取20.0mL该溶液,加入足量的AgNO3溶液,生成白色沉淀8.61g.
由此可得出原溶液组成的正确结论是( )
| A. | 一定含有Fe3+、Al3+、Clˉ,不含Na+、NH4+ | |
| B. | 一定含有Na+、Fe3+、Clˉ,不含NH4+,可能含有Al3+ | |
| C. | c (Al3+)=1.00 mol•L-1 | |
| D. | c(Na+)=0.50 mol•L-1 |
分析 根据实验①判断,原溶液中一定有Fe3+,无NH4+,根据反应前后OH-浓度的变化计算参加反应的OH-,固体0.80g为氧化铁的质量,可计算n(Fe3+),结合消耗OH-的量判断是否含有Al3+,
②另取20.0mL该溶液,加入足量的AgNO3溶液,生成白色沉淀8.61g,为AgCl的质量,可知n(Cl-),结合电荷守恒判断是否含有Na+,以此解答该题.
解答 解:根据实验①判断,原溶液中一定有Fe3+,无NH4+,
参加反应的OH-:0.020L×4.00 mol•L-1-0.10L×0.10 mol•L-1=0.07mol
n(Fe3+)=$\frac{0.80g}{{160g•mo{l^{-1}}}}×2=0.01mol$,
Fe3++3OH-=Fe(OH)3↓,
与Fe3+反应的OH-:0.01mol×3=0.03mol,所以原溶液中一定存在Al3+,
与Al3+反应的OH-:0.07mol-0.03mol=0.04mol,
滤液中还余OH-,则发生反应 Al3++4OH-=AlO2-+2H2O,
n(Al3+)=$\frac{0.04mol}{4}=0.01mol$,
c (Al3+)=$\frac{0.01mol}{0.02L}=0.50mol•L{\;}^{-1}$,
由实验②结合上面的计算数据,得 n(Cl-)=$\frac{8.61g}{{143.5g•mo{l^{-1}}}}=0.06mol$,
电荷守恒:n(Cl-)=3n(Fe3+)+3n(Al3+),所以原溶液中不含Na+,
故选A.
点评 本题考查离子反应的简单计算、常见离子的检验方法,题目难度中等,注意掌握常见离子的性质及检验方法,根据电荷守恒判断钠离子的存在为本题易错点.

练习册系列答案
相关题目
10.下列各组离子在溶液中能大量共存,加入OH-有沉淀析出,加入H+能放出气体的是( )
| A. | Na+、C1-、NO3-、H+ | B. | K+、Cl-、SO42-、H | ||
| C. | Fe3+、C1-、SO42-、NH4+ | D. | Ca2+、HCO3-、Cl-、NO3- |
8.下列过程属于物理变化的是( )
| A. | 海水晒盐 | B. | 煤的气化 | C. | 石油裂化 | D. | 氨溶于水 |
15.关于反应CH3COOH+CH3CH2OH?CH3COOCH2CH3+H2O,下列说法错误的是( )
| A. | 该反应是可逆反应 | |
| B. | 升高温度可以加快反应速率 | |
| C. | 使用催化剂可以加快反应速率 | |
| D. | 使用过量乙醇能使乙酸完全转化为乙酸乙酯 |
12.下列叙述正确的是( )
| A. | 等质量的乙烯与乙醇充分燃烧时消耗氧气的质量相等 | |
| B. | 生活中用于制造水杯、奶瓶、食物保鲜膜等用品的聚氯乙烯是通过加聚反应得到的 | |
| C. | 分子式为C6H12的某链状有机物,6个碳原子肯定在同一平面上,则与氢气加成后产物的名称为2,3-二甲基丁烷 | |
| D. | 红斑素、红曲素是常用于糖果、雪糕等食品的着色剂的主要成分,结构分别如图所示: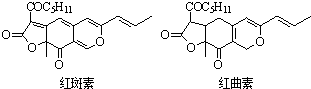 太阳能光触媒则红斑素和红曲素互为同分异构体 |
9.下列关于实验原理或操作的叙述不正确的是( )
| A. | 从碘水中提取单质碘时,不能用无水乙醇代替CCl4 | |
| B. | 利用重结晶可对粗苯甲酸进行提纯 | |
| C. | 不能用核磁共振氢谱来鉴别1-溴丙烷和2-溴丙烷 | |
| D. | 实验室中提纯混有少量乙酸的乙醇,可采用先加生石灰,过滤后再蒸馏的方法 |
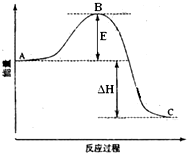 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题:
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题: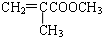 )是生产有机玻璃的单体.
)是生产有机玻璃的单体. .
. $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$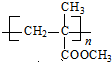 .
. 数十年来,化学工作者对碳的氧化物做了广泛深入的研究并取得了一些重要成果.
数十年来,化学工作者对碳的氧化物做了广泛深入的研究并取得了一些重要成果.