题目内容
13.已知反应A+B=C+D为放热反应,对该反应的下列说法中正确的是( )| A. | A的能量一定高于C | |
| B. | 该反应为放热反应,故不必加热就一定能发生 | |
| C. | B的能量一定高于D | |
| D. | A和B的总能量一定高于C和D的总能量 |
分析 吸热反应放热反应与反应物和生成物的总能量有关与反应条件无关,即反应物总能量高于生成物总能量则放热,否则为吸热反应.
解答 解:放热反应是指反应物的总能量大于生成物的总能量,与反应条件(如加热)无关,
A、未说明BD的能量关系,故A错误;
B、有些放热反应需要加热引发才能发生,比如物质的燃烧,故B错误;
C、未说明AC的能量关系,故C错误;
D、反应物总能量高于生成物总能量为放热反应,故D正确,
故选D.
点评 本题主要考查的是放热反应与吸热反应的定义,注意放热反应与反应物和生成物的总能量的关系,难度不大.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
2. 常温下,向1L 0.1mo1•L-1NH4C1溶液中,不断加入固体NaOH后,NH4+与NH3•H2O的浓度变化趋势如图所示(不考虑溶液体积的变化和氨的挥发),下列说法正确的是( )
常温下,向1L 0.1mo1•L-1NH4C1溶液中,不断加入固体NaOH后,NH4+与NH3•H2O的浓度变化趋势如图所示(不考虑溶液体积的变化和氨的挥发),下列说法正确的是( )
 常温下,向1L 0.1mo1•L-1NH4C1溶液中,不断加入固体NaOH后,NH4+与NH3•H2O的浓度变化趋势如图所示(不考虑溶液体积的变化和氨的挥发),下列说法正确的是( )
常温下,向1L 0.1mo1•L-1NH4C1溶液中,不断加入固体NaOH后,NH4+与NH3•H2O的浓度变化趋势如图所示(不考虑溶液体积的变化和氨的挥发),下列说法正确的是( )| A. | M点溶液中水的电离程度比原溶液大 | |
| B. | 随着NaOH的加入,NH4+与NH3•H2O物质的量总量减少 | |
| C. | 当n(NaOH)=0.05mol时,溶液中有:c(C1-)>c(Na+>c(NH4+>c(OH-)>c(H+) | |
| D. | 在M点时,n(OH-)+0.05═a+n(H+) |
4.光导纤维的主要成分是( )
| A. | 纯硅 | B. | 玻璃 | C. | SiO2 | D. | 沙子 |
8.某温度时,使用一对石墨电极电解饱和Na2SO4溶液,当转移2mol电子时停止电解,析出Na2SO4•10H2O晶体m g,所有数据都在相同温度下测得,下列叙述正确的是( )
| A. | 电解后溶液质量减少(m+36)g | |
| B. | 原溶液中Na2SO4的质量分数为$\frac{71m}{161(m+18)}$ | |
| C. | 若其它条件不变,将石墨电极替换为铜电极,则阴极析出2mol H2 | |
| D. | 若其它条件不变,将石墨电极替换为铜电极,则析出Na2SO4•10H2O晶体仍为m g |
2.下列说法正确的是( )
| A. | 向NaHSO4溶液加入Ba(OH)2溶液至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | 100 g含氢元素质量分数为12%的乙烯和乙醛(C2H4O)的混合物中,所含氧原子数目NA | |
| C. | 实验室制氯气的化学方程式:KClO3+6H37Cl(浓)═KCl+337Cl2↑+3H2O | |
| D. | 2.0 L 0.5 mo1/L NaAlO2溶液中含有氧原子的数目为 2NA |
3.已知下列操作和现象,所得结论正确的是( )
| 选项 | 操作和现象 | 结论 |
| A | 其他条件不变,缩小H2(g)+I2(g)?2HI(g)的平衡体系的容器容积,气体颜色变深 | 增大压强,平衡逆向移动 |
| B | 分别将乙烯与SO2通入酸性KMnO4溶液中,KMnO4溶液均褪色 | 两种气体使酸性KMnO4溶液褪色的原理不相同 |
| C | 用滴定管量取20.00mL稀硫酸,初读数时尖嘴管内有气泡,末读数时气泡消失 | 所取稀硫酸体积小于20.00mL |
| D | 25℃时,分别测定等物质的量浓度的NaCN溶液和NaF溶液的pH,前者pH大 | 酸性:HCN>HF |
| A. | A | B. | B | C. | C | D. | D |
 A、B、C、D、E是元素周期表中前36号元素,核电荷数依次增大,A与B能形成种类繁多的化合物,D原子中成对电子数等于未成对电子数的3倍;E+中所有电子正好充满K、L、M三个电子层.
A、B、C、D、E是元素周期表中前36号元素,核电荷数依次增大,A与B能形成种类繁多的化合物,D原子中成对电子数等于未成对电子数的3倍;E+中所有电子正好充满K、L、M三个电子层.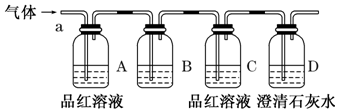

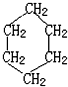 (结构简式).
(结构简式).