题目内容
18.氯气是一种有毒气体,但它是一种重要的化工原料,与我们的生活联系密切.Ⅰ.(1)据新闻报道,前不久某地装运液氯的槽罐车发生交通事故,造成大量氯气泄漏,公路附近的村民被紧急疏散.请问:村民应该如何应变CE(填编号).
A.应躲到低洼的地方去 B.可用烧碱溶液浸湿软布蒙面
C.可用肥皂水或尿液浸湿软布蒙面 D.应多饮水 E.应到较高的地方去
(2)实验室制取氯气的方法有很多种,其中之一是:KClO3+6HCl=KCl+3Cl2↑+3H2O.该反应中氧化剂是KClO3 ,还原剂是HCl,当反应生成标准状况下6.72LCl2时,转移电子的物质的量为0.5mol.
(3)日常生活环境可用稀的漂白液等进行消毒,请写出制漂白液的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.
Ⅱ.某化学兴趣小组为了探究常温下某非金属氧化物形成的未知气体的成分.该小组成员将气体通入澄清石灰水,发现澄清石灰水变浑浊,持续通入发现浑浊又变澄清,该小组成员猜测气体的成分可能是CO2,SO2或是它们的混合气体.为了验证猜测,该小组同学按如图所示装置,将气体从a端通入,则:
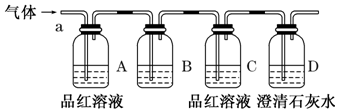
(1)B中应该装下列B试剂(填编号).
A.NaOH溶液 B.酸性KMnO4溶液 C.盐酸 D.澄清石灰水
(2)B中溶液的作用是:除去SO2气体.
(3)D中澄清石灰水的作用是:检验该气体中是否含有CO2.
(4)通过实验,该小组同学观察到以下三个实验现象:①A中品红溶液褪色 ②C中品红溶液不褪色③D中澄清石灰水变浑浊.由上述现象该小组同学得出的结论为:该气体是SO2、CO2的混合气体.
分析 Ⅰ.(1)根据氯气的密度比空气的大、氯气能被碱溶液吸收、氯气在水中的溶解度不大等性质来分析,并注意浓氢氧化钠具有强腐蚀性;
(2)从元素的化合价的变化角度分析氧化剂和还原剂,根据氧化还原反应得失电子数目相等计算转移电子的物质的量;
(3)漂白液由氯气和NaOH溶液反应生成,主要成分是NaCl和NaClO,以此书写离子方程式;
Ⅱ.猜想:气体通入澄清石灰水,发现变浑浊,持续通入发现浑浊又变澄清,说明气体为SO2,CO2中一种或两种;
由装置图可知,该实验原理为:检验SO2用品红溶液,品红溶液褪色说明含有SO2;检验CO2用澄清石灰水,澄清石灰水变浑浊,说明含有CO2,由于SO2影响CO2检验,故先检验SO2,后检验CO2,检验CO2之前用试剂SO2除去,但选择试剂不能吸收CO2,不能引入CO2,
(1)装置B的作用是除去SO2,防止影响CO2检验,选择试剂吸收二氧化硫,不能吸收CO2,不能引入CO2;
(2)装置B的目的是除去二氧化硫气体,避免二氧化硫对二氧化碳检验的干扰;
(3)在排除SO2情况下,检验CO2用澄清石灰水,澄清石灰水变浑浊,说明含有CO2;
(4)①A中品红褪色,说明气体含有SO2;②C中品红不褪色且③D中澄清石灰水变浑浊,说明含有气体中含有CO2,故该气体是SO2,CO2的混合气体.
解答 解:Ⅰ.(1)A.氯气的密度比空气的大,地势较低的地方氯气含量大,中毒的可能性大,躲到低洼的地方去不合理,故A错误;
B.用烧碱溶液浸湿软布蒙面,则会受到浓氢氧化钠的腐蚀,做法不合理,故B错误;
C.肥皂水或尿液呈碱性,氯气能溶于碱性物质的溶液,故C正确;
D.常温下氯气能溶于水,但氯气在水中的溶解度不大,多饮水不能消除氯气的危害,且氯气主要危害呼吸道,故D错误;
E.氯气的密度比空气的大,较高的地方氯气含量较少,故E正确;
故答案为:CE;
(2)KClO3+6HCl=KCl+3Cl2↑+3H2O反应中,Cl元素化合价降低,则KClO3被还原,为氧化剂,HCl为还原产物,
标准状况下6.72LCl2的物质的量为$\frac{6.72L}{22.4L/mol}$=0.3mol,转移的电子数为0.1mol×5=0.5mol,
故答案为:KClO3;HCl;0.5mol;
(3)漂白液由氯气和NaOH溶液反应生成,主要成分是NaCl和NaClO,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
Ⅱ.猜想:气体通入澄清石灰水,发现变浑浊,持续通入发现浑浊又变澄清,说明气体为SO2,CO2中一种或两种,
(1)装置B的作用是除去SO2,防止影响CO2检验,
A.氢氧化钠溶液与二氧化碳、二氧化硫都反应,无法检验二氧化碳达到存在情况,故A错误;
B.酸性高锰酸钾溶液氧化二氧化硫为硫酸,不吸收二氧化碳,故B正确;
C.盐酸不能和二氧化硫、二氧化碳反应,不能吸收二氧化硫,故C错误;
D.澄清石灰水和二氧化碳、二氧化硫都能反应,不能检验二氧化碳的存在,故D错误;
故答案为:B;
(2)装置A用于检验二氧化硫,装置D用于检验二氧化碳,检验二氧化碳前需要除去混合气体中的二氧化硫,所以装置B是用于除去二氧化硫,装置C是检验二氧化硫是否除尽,
故答案为:除去SO2气体;
(3)在排除SO2情况下,检验CO2用澄清石灰水,澄清石灰水变浑浊,说明含有CO2,装置D中澄清石灰水作用是检验CO2的存在;
故答案为:检验该气体中是否含有CO2;
(4)①A中品红褪色,说明气体含有SO2,②C中品红不褪色且③D中澄清石灰水变浑浊,说明含有气体中含有CO2,故该气体是SO2、CO2的混合气体,
故答案为:该气体是SO2、CO2的混合气体.
点评 本题考查物质的检验与物质组成的测定、对实验装置的理解、元素化合物性质等知识,题目难度中等,掌握元素化合物的性质是解题的关键,注意掌握物质性质实验方案的设计原则,试题培养了学生的分析、理解能力及化学实验能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
下列关于反应历程的先后顺序排列正确的是( )
| A. | ④③①② | B. | ③④①② | C. | ③④②① | D. | ④③②① |
①盐酸的浓度
②镁带的表面积
③溶液的温度
④压强.
| A. | ①② | B. | ③④ | C. | ①②③④ | D. | ①②③ |
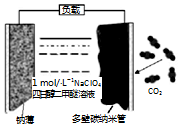 可充电“钠•二氧化碳”电池(如图),电池总反应为:4Na+3CO2$?_{充电}^{放电}$ 2Na2CO3+C,下列说法错误的是( )
可充电“钠•二氧化碳”电池(如图),电池总反应为:4Na+3CO2$?_{充电}^{放电}$ 2Na2CO3+C,下列说法错误的是( )| A. | 放电时,Na+向正极移动 | |
| B. | 放电时,电子从钠薄经负载流向多壁纳米碳管 | |
| C. | 充电时,钠薄和外接电源的负极相连,发生氧化反应 | |
| D. | 充电时,阳极的电极反应为:2Na2CO3+C-4e-═4Na++3CO2↑ |
| A. | A的能量一定高于C | |
| B. | 该反应为放热反应,故不必加热就一定能发生 | |
| C. | B的能量一定高于D | |
| D. | A和B的总能量一定高于C和D的总能量 |
| A. | 自然界中不存在游离态的碳 | B. | 碳的化合物数量众多,分布极广 | ||
| C. | 向空气中排放二氧化碳会形成酸雨 | D. | 煤、石油、天然气属于可再生碳资源 |
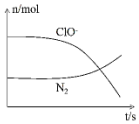 某离子反应涉及到H2O、ClO-、NH4+、OH-、N2、Cl-等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,下列说法正确的是( )
某离子反应涉及到H2O、ClO-、NH4+、OH-、N2、Cl-等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,下列说法正确的是( )| A. | 该反应中Cl-为氧化产物 | B. | 消耗1 mol还原剂,转移6 mol电子 | ||
| C. | 反应后溶液的酸性减弱 | D. | NH4+被ClO-氧化成N2 |
| A. | 乙醇、乙酸均能与NaOH溶液反应 | |
| B. | 糖类、油脂、蛋白质均能发生水解反应 | |
| C. | 通过乙烯的取代反应可制得氯乙烷 | |
| D. | C4H8Cl2有9种同分异构体 |