题目内容
4.下列物质的工业制备原理不正确的是( )| A. | 制单质氯:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑ | |
| B. | 制单质镁:2Na+MgCl2$\frac{\underline{\;高温\;}}{\;}$2NaCl+Mg | |
| C. | 制聚氯乙烯:n CH2=CHCl $\stackrel{催化剂}{→}$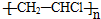 | |
| D. | 制纯碱:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl;2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O |
分析 A.工业利用电解食盐水制单质氯;
B.工业上用电解熔融氯化镁的方法制取镁;
C.氯乙烯发生加聚反应生成聚氯乙烯;
D.工业制备纯碱,主要是氨碱法:让NaCl、NH3、CO2和H2O尽可能多的转化成NaHCO3(固体沉淀物)和NH4Cl(溶液);再将NaHCO3加热生成纯碱.
解答 解:A.工业上通常采用电解食盐水制取氯气,同时得到烧碱和氢气,反应方程式为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,故A不选;
B.工业上可用电解氯化镁的方法制金属镁,其反应的原理是:MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑,故B选;
C.氯乙烯含有C=C键,可发生加聚反应,制聚氯乙烯:n CH2=CHCl $\stackrel{催化剂}{→}$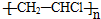 ,故C不选;
,故C不选;
D.氨碱法制纯碱,主要是让NaCl、NH3、CO2和H2O尽可能多的转化成NaHCO3(固体沉淀物)和NH4Cl(溶液),反应的化学方程式为:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl;再将NaHCO3加热生成纯碱、水和二氧化碳,反应的化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,故D不选;
故选B.
点评 本题考查物质的反应原理,注意A制单质氯实验室制法与工业制法的区别,为易错点,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
14.1g干冰(固态CO2)中含有氧原子a个,则阿伏加德罗常数可表示为( )
| A. | 22a | B. | 44a | C. | $\frac{44a}{3}$ | D. | 14a |
15.下列反应的离子方程式书写正确的是( )
| A. | 工业上用过量氨水吸收二氧化硫:NH3+SO2+H2O=NH4++HSO3- | |
| B. | 向氯化亚铁溶液中加入稀硝酸3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ | |
| C. | 向(NH4)2SO4溶液中加入适量Ba(OH)2:Ba2++SO42-=BaSO4↓ | |
| D. | 硝酸铵与热氢氧化钠浓溶液反应:NH4++OH-=NH3•H2O |
12.下列化学名词正确的是( )
| A. | 乙稀 | B. | 硝基笨 | C. | 乙酸乙脂 | D. | 氨基 |
19.下列关于太阳能、生物质能和氢能的利用说法不正确的是( )
| A. | 农村推广建造沼气池,实现了生物质能向热能的转化 | |
| B. | 光-生物质能转换的本质是光-化学能的转换 | |
| C. | 科学家们预言,氢能将成为21世纪的重要能源 | |
| D. | 化石燃料蕴藏的能量来自远古时期生物体所吸收利用的太阳能 |
9.已知铅蓄电池放电时发生如下反应:负极:Pb-2e-+SO42-=PbSO4,正极:PbO2+2e-+4H++SO42-=PbSO4+2H2O,当铅蓄电池放电转移的电子能氧化Cl-制得Cl2 22.4L(标况)时,电池内消耗的硫酸的量至少是( )
| A. | 0.5 mol | B. | 5 mol | C. | 196g | D. | 98g |
16.已知断开1molH-H键,1mol O=O键和1molH-O键所吸收的能量分别为436kJ,497kJ,462kJ,则4g H2完全燃烧,该过程中的能量变化为( )
| A. | 吸收471kJ能量 | B. | 放出479kJ能量 | C. | 吸收479kJ能量 | D. | 放出445kJ能量 |
13.下列有关甲烷分子结构的说法中,错误的是( )
| A. | 甲烷分子中含有4个C-H共价键 | |
| B. | 甲烷分子中C-H共价键的夹角为109°28' | |
| C. | 甲烷是正四面体结构 | |
| D. | 甲烷是一种直线型分子 |
4. 许多含碳、含氢物质是重要的化工原料.
许多含碳、含氢物质是重要的化工原料.
(1)某新型储氢合金(化学式为Mg17Al12)的储氧原理为Mg17Al12+17H2=17MgH2+12Al,此变化中氧化产物是MgH2(填化学式).
(2)C2O3是一种无色无味的气体,可溶于水生成草酸(H2C2O4),请写出它与足量NaOH溶液混合时反应的化学方程式:H2C2O4+2NaOH=Na2C2O4+2H2O.
(3)已知:①H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H1=-198kJ•mol-1
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H2
③CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H3=-846.3kJ•mol-1
则CH4(g)+H2O(g)?CO(g)+3H2(g)的△H=30.6KJ/mol.
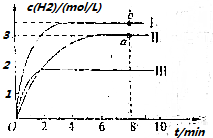
(4)向容积为2L的某恒容密闭容器中充入3molCH4、4molH2O,测出温度为T℃时,容器内H2物质的量浓度(mol/L)随时间的变化如图Ⅱ所示,图中Ⅰ、Ⅲ分别表示相对于Ⅱ仅改变反应条件后,c(H2)随时间的变化
①若曲线Ⅰ代表的是仅变化一种条件后的情况,则改变的条件可能是升温,a、b两点后用CO浓度变化表示的反应速率关系为a<b(填“>”“<”“=”).
②曲线Ⅱ对应反应的平衡常数为54,该温度下,若将等物质的量浓度的CH4、H2O、CO、H2混合在该容器中,则开始时H2的生成速率无法确定(填“>”“<”“=”或“无法确定”)H2的消耗速率.
③曲线Ⅲ相对于曲线Ⅱ改变的条件是b(填序号).
a.降低温度 b.使用催化剂、降低温度 c.充入氦气.
 许多含碳、含氢物质是重要的化工原料.
许多含碳、含氢物质是重要的化工原料.(1)某新型储氢合金(化学式为Mg17Al12)的储氧原理为Mg17Al12+17H2=17MgH2+12Al,此变化中氧化产物是MgH2(填化学式).
(2)C2O3是一种无色无味的气体,可溶于水生成草酸(H2C2O4),请写出它与足量NaOH溶液混合时反应的化学方程式:H2C2O4+2NaOH=Na2C2O4+2H2O.
(3)已知:①H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H1=-198kJ•mol-1
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H2
③CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H3=-846.3kJ•mol-1
| 化学键 | C≡O | O=O | C=O |
| 键能(kJ•mol-1) | 958.5 | 497 | 745 |
(4)向容积为2L的某恒容密闭容器中充入3molCH4、4molH2O,测出温度为T℃时,容器内H2物质的量浓度(mol/L)随时间的变化如图Ⅱ所示,图中Ⅰ、Ⅲ分别表示相对于Ⅱ仅改变反应条件后,c(H2)随时间的变化
①若曲线Ⅰ代表的是仅变化一种条件后的情况,则改变的条件可能是升温,a、b两点后用CO浓度变化表示的反应速率关系为a<b(填“>”“<”“=”).
②曲线Ⅱ对应反应的平衡常数为54,该温度下,若将等物质的量浓度的CH4、H2O、CO、H2混合在该容器中,则开始时H2的生成速率无法确定(填“>”“<”“=”或“无法确定”)H2的消耗速率.
③曲线Ⅲ相对于曲线Ⅱ改变的条件是b(填序号).
a.降低温度 b.使用催化剂、降低温度 c.充入氦气.