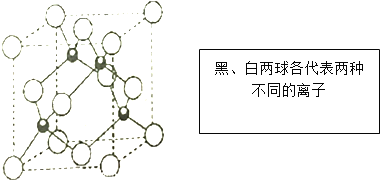
题目内容
14.1g干冰(固态CO2)中含有氧原子a个,则阿伏加德罗常数可表示为( )| A. | 22a | B. | 44a | C. | $\frac{44a}{3}$ | D. | 14a |
分析 结合n=$\frac{m}{M}$、NA=$\frac{N}{n}$及分子构成计算.
解答 解:1g干冰(固态CO2)中含有氧原子a个,干冰的物质的量为$\frac{1g}{44g/mol}$=$\frac{1}{44}$mol,O原子的物质的量为$\frac{1}{22}$mol,则阿伏加德罗常数可表示为$\frac{a}{\frac{1}{22}}$=22a,
故选A.
点评 本题考查物质的量的计算,为高频考点,把握质量、物质的量、微粒个数的关系为解答的关键,侧重分析与计算能力的考查,注意分子的构成,题目难度不大.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
5.下列说法不正确的是( )
①CH3-CH═CH2和CH2═CH2的最简式相同
②CH≡CH和C6H6含碳量相同
③丁二烯和丁烯为同系物
④正戊烷、异戊烷、新戊烷的沸点逐渐变低
⑤标准状况下,11.2L的庚烷所含的分子数为0.5NA(NA为阿伏加德罗常数)
①CH3-CH═CH2和CH2═CH2的最简式相同
②CH≡CH和C6H6含碳量相同
③丁二烯和丁烯为同系物
④正戊烷、异戊烷、新戊烷的沸点逐渐变低
⑤标准状况下,11.2L的庚烷所含的分子数为0.5NA(NA为阿伏加德罗常数)
| A. | ①⑤ | B. | ②③④ | C. | ③⑤ | D. | ④⑤ |
9.在标准状况下,1体积水溶解700体积氨气,所得溶液密度为0.9g•cm-3,这种氨水的物质的量浓度和溶质的质量分数分别为( )
| A. | 18.4mol•L-1 34.7% | B. | 20.4mol•L-1 38.5% | ||
| C. | 18.4mol•L-1 38.5% | D. | 20.4mol•L-1 34.7% |
6.与50ml 0.2mol/L的Na2CO3溶液中Na+浓度相等的溶液是( )
| A. | 100ml 0.2mol/L的NaCl溶液 | B. | 50ml 0.1mol/L的Na2SO4溶液 | ||
| C. | 150ml 0.2mol/L的NaNO3溶液 | D. | 1000ml 0.2mol/L的Na2SO3溶液 |
3.某反应2A(g)+B(g)?C(g)经10s后A的物质的量浓度为0.2mol/L,B的物质的浓度降低了0.02mol/L,
则A物质的起始浓度为( )
则A物质的起始浓度为( )
| A. | 0.24 mol/L | B. | 0.6 mol/L | C. | 2.4 mol/L | D. | 4.2 mol/L |
4.下列物质的工业制备原理不正确的是( )
| A. | 制单质氯:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑ | |
| B. | 制单质镁:2Na+MgCl2$\frac{\underline{\;高温\;}}{\;}$2NaCl+Mg | |
| C. | 制聚氯乙烯:n CH2=CHCl $\stackrel{催化剂}{→}$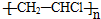 | |
| D. | 制纯碱:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl;2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O |
 氧化还原反应在生产、生活中具有广泛的用途.请回答下列问题:
氧化还原反应在生产、生活中具有广泛的用途.请回答下列问题:
 ;D分子的空间构型为V型.
;D分子的空间构型为V型.