题目内容
16.已知断开1molH-H键,1mol O=O键和1molH-O键所吸收的能量分别为436kJ,497kJ,462kJ,则4g H2完全燃烧,该过程中的能量变化为( )| A. | 吸收471kJ能量 | B. | 放出479kJ能量 | C. | 吸收479kJ能量 | D. | 放出445kJ能量 |
分析 由信息可知,H-H键能为436kJ/mol,O=O键能为497kJ/mol,H-O键能为462kJ/mol,2H2(g)+O2(g)=2H2O(l)中,△H=反应物中键能和-生成物中键能和,以此来解答.
解答 解:常温下拆开1mol H2中的化学键要吸收436kJ的能量,拆开1mol O2中的化学键要吸收497kJ的能量,形成水分子中的1mol H-O键要放出462kJ的能量,则H-H键能为436kJ/mol,O=O键能为497kJ/mol,H-O键能为462kJ/mol,由2H2(g)+O2(g)=2H2O(l)中,△H=反应物中键能和-生成物中键能和=2×436kJ/mol+497kJ/mol-4×462kJ/mol=-479kJ/mol,△H=-479kJ/mol,所以4g H2完全燃烧,放出479kJ能量,故选B.
点评 本题考查反应热的计算,为高频考点,把握键能与反应热的关系、焓变正负的意义为解答的关键,侧重分析能力与计算能力的考查,题目难度不大.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
6.与50ml 0.2mol/L的Na2CO3溶液中Na+浓度相等的溶液是( )
| A. | 100ml 0.2mol/L的NaCl溶液 | B. | 50ml 0.1mol/L的Na2SO4溶液 | ||
| C. | 150ml 0.2mol/L的NaNO3溶液 | D. | 1000ml 0.2mol/L的Na2SO3溶液 |
7.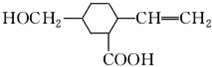 某有机物的结构如图所示,下列各项性质中,它不可能具有的是( )
某有机物的结构如图所示,下列各项性质中,它不可能具有的是( )
①可以燃烧 ②能使酸性KMnO4溶液褪色 ③能跟NaOH溶液反应 ④能发生酯化反应 ⑤能发生聚合反应 ⑥能发生水解反应 ⑦能发生取代反应.
 某有机物的结构如图所示,下列各项性质中,它不可能具有的是( )
某有机物的结构如图所示,下列各项性质中,它不可能具有的是( )①可以燃烧 ②能使酸性KMnO4溶液褪色 ③能跟NaOH溶液反应 ④能发生酯化反应 ⑤能发生聚合反应 ⑥能发生水解反应 ⑦能发生取代反应.
| A. | ①④ | B. | ⑤ | C. | ④⑥ | D. | ⑥ |
4.下列物质的工业制备原理不正确的是( )
| A. | 制单质氯:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑ | |
| B. | 制单质镁:2Na+MgCl2$\frac{\underline{\;高温\;}}{\;}$2NaCl+Mg | |
| C. | 制聚氯乙烯:n CH2=CHCl $\stackrel{催化剂}{→}$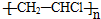 | |
| D. | 制纯碱:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl;2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O |
11.可逆反应N2+3H2?2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示.下列各关系中能说明反应已达到平衡状态的是( )
| A. | 3v生成(N2)=v生成(H2) | B. | v消耗(N2)=v消耗(NH3)? | ||
| C. | v消耗(N2)=3v生成(H2)? | D. | 2v消耗(H2)=3v消耗(NH3) |
1.柠檬烯是一种食用香料,结构简式如图,有关柠檬烯的分析正确的是( )


| A. | 柠檬烯的一氯代物有8种 | |
| B. | 柠檬烯和  互为同分异构体 互为同分异构体 | |
| C. | 柠檬烯的分子中所有的碳原子可能在同一个平面上 | |
| D. | 一定条件下,柠檬烯可以发生加成、取代、氧化、加聚、酯化等反应 |
8.化学与生活密切相关,下列有关说法错误的是( )
| A. | 用灼烧的方法可以区分蚕丝和人造纤维 | |
| B. | 医用消毒酒精中乙醇的浓度为95% | |
| C. | 加热能杀死流感病毒是因为蛋白质受热变性 | |
| D. | 食用油反复加热会产生稠环芳香烃等有害物质 |
16.COCl2的分解反应为COCl2(g)?Cl2(g)+CO(g).将一定量COCl2(g)和Cl2(g)放入一密闭容器中,2min时达到平衡后,各物质的物质的量在不同条件下的变化情况如图所示.下列相关说法中不正确的是
( )
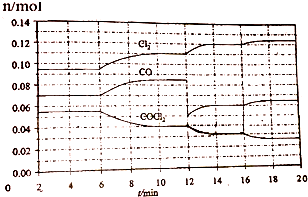
( )

| A. | 1min时以CO表示的逆反应速率小于3min时以CO表示的正反应速率 | |
| B. | 若在6min时改变的条件为升高温度,则反应的平衡常数K增大 | |
| C. | 12min时改变的条件可为减小CO的浓度,16min时改变的条件可为增大反应容器的体积 | |
| D. | 以CO表示在4~5min、10~11min和12~13min时平均反应速率为v(4~5)<v(10~11)<v(12~13) |
 有如图所示装置,为实现下列实验目的,其中Y端适合于作入口的是ABE.
有如图所示装置,为实现下列实验目的,其中Y端适合于作入口的是ABE.