题目内容
 氮元素在地球上含量丰富,氮及其化合物在工农业生产、生活中有着重要作用.
氮元素在地球上含量丰富,氮及其化合物在工农业生产、生活中有着重要作用.(1)硝酸与盐酸、浓硫酸并称为工业三大强酸,下面从不同的角度对硝酸、盐酸、浓硫酸进行分类,试将尚未完成的类别名称分别填在相应的空格内.
(2)稀硫酸不能与铜反应,但稀硝酸可以与铜反应,反应的
方程式为(未配平):
①配平上述反应方程式(将各物质的计量系数填在横线上);
②该反应的氧化剂是
(3)二氧化氮(NO2)在工业上可以用来制硝酸,反应式为3NO2+H2O═2HNO3+NO,当有6mol电子发生转移时,被氧化的物质与被还原的物质的物质的量之比为
(4)亚硝酸钠(NaNO2)是一种工业盐,外观和食盐相似,但有毒.某工厂废切削液中含有2%~5%的NaNO2,直接排放会造成水污染,但加入下列物质中的某一种就能使NaNO2转化为不引起污染的N2,该物质是
A.NaCl B.H2O2 C.NH4Cl D.浓H2SO4.
考点:含氮物质的综合应用,氧化还原反应方程式的配平,氧化还原反应的计算
专题:氧化还原反应专题,氮族元素
分析:(1)硝酸、盐酸都是一元酸,而硝酸、浓硫酸都是含氧酸;
(2)先根据化合价升降守恒,再根据质量守恒配平,反应物中元素化合价升高的物质为还原剂,对应的产物为氧化产物,元素化合价降低的物质为氧化剂;
(3)由方程式可知3NO2+H2O═2HNO3+NO,转移2mol电子发生转移时,2molNO2被氧化与1molNO2被还原;
(4)NaNO2转化为不引起污染的N2,NaNO2被还原,所以应加还原剂,而且发生氧化还原过程中不引入新的杂质.
(2)先根据化合价升降守恒,再根据质量守恒配平,反应物中元素化合价升高的物质为还原剂,对应的产物为氧化产物,元素化合价降低的物质为氧化剂;
(3)由方程式可知3NO2+H2O═2HNO3+NO,转移2mol电子发生转移时,2molNO2被氧化与1molNO2被还原;
(4)NaNO2转化为不引起污染的N2,NaNO2被还原,所以应加还原剂,而且发生氧化还原过程中不引入新的杂质.
解答:
解:(1)硝酸、盐酸都是一元酸,而硝酸、浓硫酸都是含氧酸,故答案为:一元酸、二元酸、含氧酸;
(2)①
升降守恒,铜前面的系数为3,而还原产物一氧化氮前面系数为2,然后根据质量守恒得其它各物质前面的系数,分别为:3、8、3、2、4,故答案为:3、8、3、2、4;
②反应物中元素化合价升高的物质为还原剂,对应的产物为氧化产物,元素化合价降低的物质为氧化剂,氧化剂是HNO3,氧化产物是 Cu (NO3)2,
故答案为:HNO3,Cu (NO3)2;
(3)由方程式可知3NO2+H2O═2HNO3+NO,转移2mol电子发生转移时,2molNO2被氧化与1molNO2被还原,则有6mol电子发生转移时,被氧化的物质与被还原的物质的物质的量之比为2×3:1×3=2:1,故答案为:2:1;
(4)NaNO2转化为不引起污染的N2,NaNO2被还原,所以应加还原剂,而且发生氧化还原过程中不引入新的杂质,综合考虑选用NH4Cl,故选C.
(2)①
|
②反应物中元素化合价升高的物质为还原剂,对应的产物为氧化产物,元素化合价降低的物质为氧化剂,氧化剂是HNO3,氧化产物是 Cu (NO3)2,
故答案为:HNO3,Cu (NO3)2;
(3)由方程式可知3NO2+H2O═2HNO3+NO,转移2mol电子发生转移时,2molNO2被氧化与1molNO2被还原,则有6mol电子发生转移时,被氧化的物质与被还原的物质的物质的量之比为2×3:1×3=2:1,故答案为:2:1;
(4)NaNO2转化为不引起污染的N2,NaNO2被还原,所以应加还原剂,而且发生氧化还原过程中不引入新的杂质,综合考虑选用NH4Cl,故选C.
点评:本题考查氧化还原反应,侧重氧化还原反应基本概念的考查,明确反应中元素的化合价变化即可解答,注重基础知识的训练,题目难度不大.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
下列关于热化学的说法正确的是( )
| A、需要加热才能发生的反应是吸热反应 |
| B、等量的金刚石和石墨固体分别完全燃烧,前者放出热量多,说明金刚石更稳定 |
| C、化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关 |
| D、由热化学方程式 3H2(g)+N2(g)?2NH3(g)△H=-92 kJ/mol可知,1molN2与3molH2放入密闭容器中,在催化剂的作用下反应得到氨气,将释放92kJ热量 |
与盐酸或氢氧化钠溶液反应都能放出氢气的是( )
| A、Cu | B、Mg | C、Fe | D、Al |

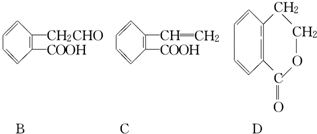
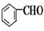 +CH3CHO
+CH3CHO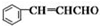 +H2O
+H2O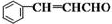 侧链上可能发生反应的类型:
侧链上可能发生反应的类型: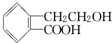 ,它可通过不同化学反应分别制得B、C和D三种物质.
,它可通过不同化学反应分别制得B、C和D三种物质.