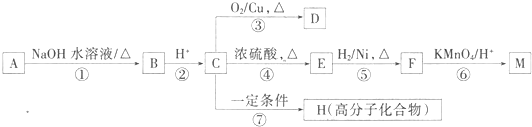
题目内容
已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O
(1)用双线桥法分析上述反应(只需标出电子得失的方向和数目)3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O.
(2)上述反应中氧化剂是 ,氧化产物是 .
(3)上述反应中氧化剂与还原剂的物质的量之比为 .
(4)若反应中转移了0.6mol电子,产生的气体在标准状况下的体积是 .
(1)用双线桥法分析上述反应(只需标出电子得失的方向和数目)3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O.
(2)上述反应中氧化剂是
(3)上述反应中氧化剂与还原剂的物质的量之比为
(4)若反应中转移了0.6mol电子,产生的气体在标准状况下的体积是
考点:氧化还原反应
专题:氧化还原反应专题
分析:3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O中,Cu元素的化合价由0升高为+2价,N元素的化合价由+5价降低为+2价,该反应转移6e-,以此来解答.
解答:
解:(1)该反应中Cu元素化合价由0价变为+2价、部分N元素化合价由+5价变为+2价,其得失电子最小公倍数是6,
用双线桥标出该反应电子转移的方向和数目为 ,
,
故答案为: ;
;
(2)N元素的化合价降低,则HNO3为氧化剂,Cu元素被氧化,则氧化产物为Cu(NO3)2,
故答案为:HNO3;Cu(NO3)2;
(3)Cu为还原剂,HNO3为氧化剂,3molCu失去电子与2molN得到电子相同,则氧化剂与还原剂的物质的量之比为2:3,故答案为:2:3;
(4)该反应转移6e-,若反应中转移了0.6mol电子,产生的气体在标准状况下的体积是0.2mol×22.4L/mol=4.48L,故答案为:4.48L.
用双线桥标出该反应电子转移的方向和数目为
 ,
,故答案为:
 ;
;(2)N元素的化合价降低,则HNO3为氧化剂,Cu元素被氧化,则氧化产物为Cu(NO3)2,
故答案为:HNO3;Cu(NO3)2;
(3)Cu为还原剂,HNO3为氧化剂,3molCu失去电子与2molN得到电子相同,则氧化剂与还原剂的物质的量之比为2:3,故答案为:2:3;
(4)该反应转移6e-,若反应中转移了0.6mol电子,产生的气体在标准状况下的体积是0.2mol×22.4L/mol=4.48L,故答案为:4.48L.
点评:本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重电子的转移、氧化剂和还原剂的判断及计算的考查,注意从化合价角度分析,难度不大.

练习册系列答案
 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
下列有关化学用语使用正确的是( )
A、硫原子的原子结构示意图: | ||
B、NH4Cl的电子式: | ||
C、核内有8个中子的碳原子:
| ||
| D、HCO3-电离的离子方程式:HCO3-+H2O?CO32-+H3O+ |
下列物质按纯净物、混合物、强电解质、弱电解质、非电解质的组合中,正确的是( )
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 盐酸 | 水煤气 | 硫酸 | 醋酸 | HD |
| B | 冰醋酸 | 福尔马林 | 苛性钾 | HI | 乙醇 |
| C | 火碱 | 蔗糖溶液 | 氯化钠 | 氨水 | 三氧化硫 |
| D | 胆矾 | 石灰水 | 硫酸钡 | HNO2 | NH3 |
| A、A、 | B、B、 | C、C、 | D、D、 |
将2molS02和1molO2放入一个容器中,在一定的条件下反应到达平衡状态,此时,容器存在的各物质的物质的量中,其中不能的是:( )
①0molS02; ②1mol S02; ③2mol S03; ④0.3molO2; ⑤0.1molSO3; ⑥1molO2.
①0molS02; ②1mol S02; ③2mol S03; ④0.3molO2; ⑤0.1molSO3; ⑥1molO2.
| A、①②⑤⑥ | B、①③⑥ |
| C、①③④⑥ | D、②④⑤ |
实验室制Cl2反应为4HCl(浓)+MnO2
MnCl2+Cl2↑+2H2O下列说法不正确的是( )
| ||
| A、还原剂是浓HCl,氧化剂是MnO2 |
| B、每生成1mol Cl2,转移电子2mol |
| C、每消耗1mol MnO2,浓HCl被还原4mol |
| D、转移1mol电子时,生成的Cl2在标准状况下体积为11.2 L |
镁、铝、锌、铁四种金属共20g,使其与稀硫酸恰好完全反应,将反应后所得溶液蒸干,得固体116g,则反应过程中产生气体的体积在标准状况下约为( )
| A、44.8L | B、33.6L |
| C、22.4L | D、无法确定 |