题目内容
实验室可用NH4HCO3和NaCl为原料制备纯碱.请根据下表数据和实验步骤,回答下列问题:30℃时几种盐的溶解度/g
制备纯碱的步骤如下:
①配制50mL约25%的粗食盐水溶液(密度近似为1g/cm3).
②精制食盐水(粗食盐中含有少量Ca2+、Mg2+、SO
等杂质)用盐酸将滤液的pH值调至7.
③加热食盐水,将溶液温度控制在30℃~35℃.
④在不断搅拌下,分次将研细的NH4HCO3加入食盐水中,加完料后,继续保温、搅拌半小时.
⑤静置,趁热过滤,回收母液.晶体用蒸馏水洗涤两次.
⑥将晶体灼烧,得到纯碱.
(1)步骤①中,配制溶液的最后一步操作是 ;
(2)步骤②中,SO42-是否需要除去? ,理由是 .
(3)步骤④中所有操作的共同目的是 ;
(4)步骤⑤中晶体的洗涤液中主要含有的杂质阳离子是 .
| NaCI | NH4HCO3 | NaHCO3 | NH4CI | Na2SO4 | (NH4)SO4 | CaCI2 | MgCI2 | CaSO4 |
| 36.3 | 27.0 | 11.1 | 41.4 | 40.8 | 78 | 51.7 | 26.2 | 0.165 |
①配制50mL约25%的粗食盐水溶液(密度近似为1g/cm3).
②精制食盐水(粗食盐中含有少量Ca2+、Mg2+、SO
2- 4 |
③加热食盐水,将溶液温度控制在30℃~35℃.
④在不断搅拌下,分次将研细的NH4HCO3加入食盐水中,加完料后,继续保温、搅拌半小时.
⑤静置,趁热过滤,回收母液.晶体用蒸馏水洗涤两次.
⑥将晶体灼烧,得到纯碱.
(1)步骤①中,配制溶液的最后一步操作是
(2)步骤②中,SO42-是否需要除去?
(3)步骤④中所有操作的共同目的是
(4)步骤⑤中晶体的洗涤液中主要含有的杂质阳离子是
考点:纯碱工业(侯氏制碱法)
专题:实验题
分析:配制50mL约25%的粗食盐水溶液(密度近似为1g/cm3),计算出所需的粗盐的质量为m=12.5g,用托盘天平称量后放在小烧杯里,加水至溶液体积为50mL,搅拌使其完全溶解;加NaOH和Na2CO3除去Mg2+、Ca2+,调pH=7,此时溶液中仍有SO42-;控温在30-35℃,加NH4HCO3后搅拌,使NaHCO3充分析出后,母液中有SO42--和NH4+.据此分析.
(1)配制一定溶质质量分数的溶液,一般要经过计算、称量(或量取)、溶解(或稀释)、装瓶存放等步骤.
(2)可能存在的硫酸盐Na2SO4和(NH4)SO4的溶解度比NaHCO3大;
(3)根据加入NH4HCO3的目的是生成NaHCO3来分析;
(4)根据加入NH4HCO3会引入NH4+来分析.
(1)配制一定溶质质量分数的溶液,一般要经过计算、称量(或量取)、溶解(或稀释)、装瓶存放等步骤.
(2)可能存在的硫酸盐Na2SO4和(NH4)SO4的溶解度比NaHCO3大;
(3)根据加入NH4HCO3的目的是生成NaHCO3来分析;
(4)根据加入NH4HCO3会引入NH4+来分析.
解答:
解:配制50mL约25%的粗食盐水溶液(密度近似为1g/cm3),计算出所需的粗盐的质量为m=12.5g,用托盘天平称量后放在小烧杯里,加水至溶液体积为50mL,搅拌使其完全溶解;加NaOH和Na2CO3除去Mg2+、Ca2+,调pH=7,此时溶液中仍有SO42-;控温在30-35℃,加NH4HCO3后搅拌,使NaHCO3充分析出后,母液中有SO42--和NH4+.
(1)配制50mL约25%的粗食盐水溶液(密度近似为1g/cm3),所需的粗盐的质量为m=50g×25%=12.5g,用托盘天平量取12.5g粗盐后,放入小烧杯里,加水至溶液体积为50mL,用玻璃棒搅拌使其完全溶解即可,故答案为:用玻璃棒搅拌;
(2)在步骤②中,加入NaOH和Na2CO3除去Mg2+、Ca2+,调pH=7,此时溶液中仍有SO42-;但SO42-不用除去,原因是可能存在的硫酸盐Na2SO4和(NH4)SO4的溶解度比NaHCO3大,在NaHCO3析出时,硫酸盐不会析出,且SO42-含量少,过滤后会留在母液中,
故答案为:不需要;除去Ca2+、Mg2+后,在溶液所控制的温度下,可能存在的硫酸盐的溶解度比NaHCO3大,且SO42-含量少,过滤后会留在母液中;
(3)加入NH4HCO3的目的是生成NaHCO3,故步骤④中所有操作的共同目的是使生成NaHCO3的反应充分进行,故答案为:使生成NaHCO3的反应充分进行;
(4)在步骤②中,SO42--未除去,在步骤④中加入NH4HCO3会引入NH4+,故步骤⑤中晶体的洗涤液中含杂质离子为SO42-和NH4+,其中阳离子为NH4+,故答案为:NH4+.
(1)配制50mL约25%的粗食盐水溶液(密度近似为1g/cm3),所需的粗盐的质量为m=50g×25%=12.5g,用托盘天平量取12.5g粗盐后,放入小烧杯里,加水至溶液体积为50mL,用玻璃棒搅拌使其完全溶解即可,故答案为:用玻璃棒搅拌;
(2)在步骤②中,加入NaOH和Na2CO3除去Mg2+、Ca2+,调pH=7,此时溶液中仍有SO42-;但SO42-不用除去,原因是可能存在的硫酸盐Na2SO4和(NH4)SO4的溶解度比NaHCO3大,在NaHCO3析出时,硫酸盐不会析出,且SO42-含量少,过滤后会留在母液中,
故答案为:不需要;除去Ca2+、Mg2+后,在溶液所控制的温度下,可能存在的硫酸盐的溶解度比NaHCO3大,且SO42-含量少,过滤后会留在母液中;
(3)加入NH4HCO3的目的是生成NaHCO3,故步骤④中所有操作的共同目的是使生成NaHCO3的反应充分进行,故答案为:使生成NaHCO3的反应充分进行;
(4)在步骤②中,SO42--未除去,在步骤④中加入NH4HCO3会引入NH4+,故步骤⑤中晶体的洗涤液中含杂质离子为SO42-和NH4+,其中阳离子为NH4+,故答案为:NH4+.
点评:本题考查了粗盐的提纯和侯氏制碱法的变形应用,应注意的是由于题目所给信息中硫酸盐的溶解度比NaHCO3大,且SO42-含量少,过滤后会留在母液中,故SO42-不用除去.

练习册系列答案
相关题目
物质的量相同的N2、O2、CO2混合后,通过Na2O2颗粒一段时间,测得体积变为原混合气体体积的
(同温同压下),此时N2、O2、CO2的物质的量之比为( )
| 8 |
| 9 |
| A、1:1:0 |
| B、6:9:0 |
| C、3:4:1 |
| D、3:3:2 |
下列说法不正确的是( )
| A、SO2、Na2O2、活性炭都能使品红溶液褪色,但原理不同 |
| B、水在3.98℃时,主要以(H2O)2存在,这两个水分子间是以共价键相结合 |
| C、放热反应 的反应速率,不一定比吸热反应的反应速快 |
| D、同温同压下,3mol C2H4(g)和1mol CO(g)的密度相等 |








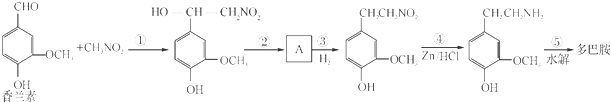
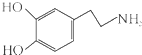 多巴胺是一种神经递质,用来帮助细胞传送脉冲的化学物质.这种脑内分泌物主要负责大脑的情感,将兴奋及开心的信息传递,使人感到愉悦和快乐.多巴胺可由香兰素与硝基甲烷缩合,再经锌还原水解而得,合成过程如下:
多巴胺是一种神经递质,用来帮助细胞传送脉冲的化学物质.这种脑内分泌物主要负责大脑的情感,将兴奋及开心的信息传递,使人感到愉悦和快乐.多巴胺可由香兰素与硝基甲烷缩合,再经锌还原水解而得,合成过程如下: