题目内容
1.92g Cu投入一定量的浓HNO3中,铜完全溶解,生成气体的颜色越来越淡,共收集到672mL气体(标准状况).将盛有此气体的容器倒扣在水中,容器内液面上升,再通入标准状况下一定体积的氧气,恰好使气体完全溶于水中,则通入O2的体积是( )
| A、504 mL |
| B、168 mL |
| C、336 mL |
| D、224 mL |
考点:氧化还原反应的计算
专题:
分析:根据电子守恒计算,已知HNO3
NO、NO2
HNO3,反应前后HNO3的物质的量不变,而化合价变化的只有铜和氧气,则Cu失去电子数目等于O2得到电子的数目,以此进行计算.
| Cu |
| O2 |
解答:
解:1.92g Cu的物质的量为n(Cu)=
=0.03mol,反应时失去电子数目为2×0.03mol=0.06mol,
反应整个过程为HNO3
NO、NO2
HNO3,反应前后HNO3的物质的量不变,而化合价变化的只有铜和氧气,则Cu失去电子数目等于O2得到电子的数目,所以消耗氧气的物质的量为n(O2)
=0.015mol,V(O2)=0.015mol×22400ml/mol=336ml,所以通入O2的体积为336ml,
故选C.
| 1.92g |
| 64g/mol |
反应整个过程为HNO3
| Cu |
| O2 |
| 0.06mol |
| 4 |
故选C.
点评:本题考查氧化还原反应电子转移数目的计算,本题难度不大,根据HNO3
NO、NO2
HNO3,得出Cu失去电子数目等于O2得到电子的数目是解答本题的关键.
| Cu |
| O2 |

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列操作,无法实现实验目的是( )
| A.目的:浓度对化学反应速率的影响 | B.目的:配制银氨溶液 |
加入 1mol/L 1mL硫酸 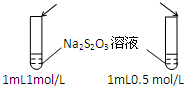 |
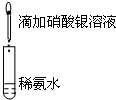 |
| C.目的:温度对化学平衡的影响 | D.目的:探究醋酸、碳酸、苯酚的酸性强弱 |
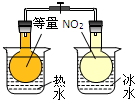 |
 |
| A、A | B、B | C、C | D、D |
相同条件下,在容积相同的三个烧瓶内分别充满干燥的NH3、HCl、NO2气体,做喷泉实验,所得三种溶液的物质的量浓度比为( )
| A、3:3:2 | B、2:2:3 |
| C、1:1:1 | D、无法比较 |
元素周期表是一座开放的“元素大厦”,“元素大厦”尚未客满.若发现92号元素,请在“元素大厦”中安排好它的“房间”( )
| A、第七周期第ⅢB族 |
| B、第六周期第ⅡA族 |
| C、第八周期第ⅠA族 |
| D、第七周期第ⅥB族 |
某MCFC型燃料电池可同时供应电和水蒸汽,其工作温度为600℃~700℃,所用燃料为氢气,电解质为熔融的K2CO3.该电池的总反应为:2H2+O2═2H2O,负极电极反应式为:H2+CO32--2e-→H2O+CO2.则下列判断中正确的是( )
| A、放电时CO32-向负极移动 |
| B、放电时CO32-向正极移动 |
| C、正极反应:4OH--4e-═2H2O+O2↑ |
| D、当电池中生成1 mol水时,转移4 mol电子 |
下列说法中,正确的是( )
| A、苯、乙醇和乙酸都能发生取代反应 |
| B、CH3CH2CH2CH3的二氯取代产物只有5种结构 |
| C、在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
| D、使用溴的四氯化碳溶液或酸性KMnO4溶液都可以除去乙烷中混有的乙烯 |
下列四种有机物在核磁共振氢谱图中特征峰个数与(CH3)2CHCH2CH3一样多的是( )
| A、(CH3)2CHCH(CH3)2 |
| B、(CH3CH2)2CHOH |
C、 |
D、 |
下列在水溶液中的电离方程式中,正确的是( )
| A、CH3COOH═CH3COO-+H+ |
| B、Ba(OH)2═Ba2++2OH- |
| C、Al2(SO4)3═2Al3++3SO42- |
| D、NaHCO3═Na++H++CO32- |