题目内容
有一可逆反应2A(g)+3B(g)?4C(g)+D(g),已知起始浓度c(A)=2mol/L,c(B)=3mol/L,c(C)=c(D)=0,反应开始20min后达到平衡状态,此时D的平衡浓度为0.5mol/L,则下列说法不正确的是( )
| A、前20 min的平均反应速率v(C)=0.1 mol/(L?min) |
| B、A的转化率为50% |
| C、C的平衡浓度c(C)=4 mol/L |
| D、B的平衡浓度c(B)=1.5 mol/L |
考点:化学平衡的计算
专题:
分析:利用三段式法计算:
2A(g)+3B(g)?4C(g)+D(g),
起始(mol/l) 2 3 0 0
转化(mol/l) 1 1.5 2 0.5
平衡(mol/l) 1 1.5 2 0.5
结合对应的数据计算各物理量及转化率.
2A(g)+3B(g)?4C(g)+D(g),
起始(mol/l) 2 3 0 0
转化(mol/l) 1 1.5 2 0.5
平衡(mol/l) 1 1.5 2 0.5
结合对应的数据计算各物理量及转化率.
解答:
解:利用三段式法计算:
2A(g)+3B(g)?4C(g)+D(g),
起始(mol/l) 2 3 0 0
转化(mol/l) 1 1.5 2 0.5
平衡(mol/l) 1 1.5 2 0.5
A.前20 min的平均反应速率v(C)=
=0.1mol/(L.min),故A正确;
B.A的转化率为
×100%=50%,故B正确;
C.C的平衡为浓度为2mol/L,故C错误;
D.B的平衡浓度为1.5mol/L,故D正确.
故选C.
2A(g)+3B(g)?4C(g)+D(g),
起始(mol/l) 2 3 0 0
转化(mol/l) 1 1.5 2 0.5
平衡(mol/l) 1 1.5 2 0.5
A.前20 min的平均反应速率v(C)=
| 2mol/L |
| 20min |
B.A的转化率为
| 1 |
| 2 |
C.C的平衡为浓度为2mol/L,故C错误;
D.B的平衡浓度为1.5mol/L,故D正确.
故选C.
点评:本题考查化学平衡的计算,难度不大,注意利用三段式法计算出平衡浓度为解答该题的关键,答题时注意体会.

练习册系列答案
相关题目
现有含NaCl、Na2SO4和NaNO3的混合溶液,采用下列实验流程加入适当的试剂将其转化为相应的沉淀或固体,实现Cl-、SO42-和NO3-的相互分离其中试剂1、2、4分别为( )
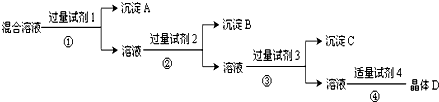

| A、氯化钡溶液 硝酸银溶液 硝酸溶液 |
| B、氯化钡溶液 硝酸溶液 硝酸银溶液 |
| C、NaOH 溶液 硝酸银溶液 硝酸溶液 |
| D、硝酸银溶液 硝酸钡溶液 硝酸溶液 |
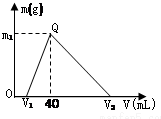 常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到200mL c(OH-)=0.1mol/L的溶液,然后逐滴加入1mol/L的盐酸,测得生成沉淀的质量m与消耗盐酸的体积V关系如图所示,则下列说法正确的是( )
常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到200mL c(OH-)=0.1mol/L的溶液,然后逐滴加入1mol/L的盐酸,测得生成沉淀的质量m与消耗盐酸的体积V关系如图所示,则下列说法正确的是( )| A、原合金质量为 0.92 g |
| B、图中V2为 100 |
| C、整个加入盐酸过程中 Na+的浓度保持不变 |
| D、Q点m1为0.78 |
下列各组物质可按照溶解、过滤、蒸发的操作顺序分离的是( )
| A、食盐和泥沙 |
| B、食盐和硝酸钾 |
| C、铁粉和锌粉 |
| D、水和酒精 |
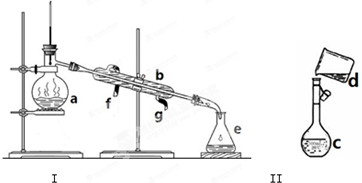 掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.