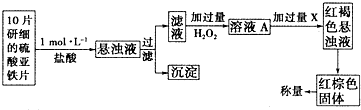
题目内容
4.如图为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题.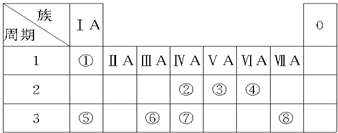
(1)④、⑤、⑥的原子半径由大到小的顺序为(填元素符号)Na>Al>O.
(2)②、③、⑦的最高价氧化物的水化物酸性由强到弱的顺序是(填化学式)HNO3>H2CO3>H2SiO3.
(3)①、④、⑤中的某些元素可形成既含离子键又含共价键的化合物,写出其中一种化合物的电子式:
 或
或 .
.(4)由②和④组成,且②和④的质量比为3:8的化合物的结构式是O=C=O,其中含极性共价键键.
(5)⑥的最高价氧化物的水化物与⑤的最高价氧化物的水化物反应的离子方程式为Al(OH)3+OH-═AlO2-++2H2O.
分析 根据元素在周期表中的位置知,①②③④⑤⑥⑦⑧分别是H、C、N、O、Na、Al、Si、Cl元素,
(1)原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
(2)元素的非金属性越强,其最高价氧化物的水化物酸性越强;
(3)①、④、⑤中的某些元素可形成既含离子键又含共价键的化合物有氢氧化钠、过氧化钠;
(4)由②和④组成,且②和④的质量比为3:8的化合物,原子个数比为$\frac{3}{12}$:$\frac{8}{16}$=1:2,为CO2,其分子中含极性共价键;
(5)⑥的最高价氧化物的水化物是氢氧化铝,⑤的最高价氧化物的水化物是NaOH,它们发生反应生成偏铝酸钠和水.
解答 解:根据元素在周期表中的位置知,①②③④⑤⑥⑦⑧分别是H、C、N、O、Na、Al、Si、Cl元素,
(1)原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,所以原子半径大小顺序是Na>Al>O,
故答案为:Na>Al>O;
(2)元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性N>C>Si,所以其最高价氧化物的水化物酸性HNO3>H2CO3>H2SiO3,
故答案为:HNO3>H2CO3>H2SiO3;
(3)①、④、⑤中的某些元素可形成既含离子键又含共价键的化合物有氢氧化钠、过氧化钠,电子式为: ,
, ,
,
故答案为: 或
或 ;
;
(4)由②和④组成,且②和④的质量比为3:8的化合物,原子个数比为$\frac{3}{12}$:$\frac{8}{16}$=1:2,为CO2,结构式为O=C=O,含极性共价键,
故答案为:O=C=O;极性共价键;
(5)⑥的最高价氧化物的水化物是氢氧化铝,⑤的最高价氧化物的水化物是NaOH,它们发生反应生成偏铝酸钠和水,离子方程式为:Al(OH)3+OH-═AlO2-++2H2O,
故答案为:Al(OH)3+OH-═AlO2-++2H2O.
点评 本题考查位置、结构性质的综合应用,为高频考点,根据元素在周期表中的物质可推断出元素的种类,题中侧重于周期律的应用,学习中注意积累相关知识,把握电子式、反应方程式、离子反应等化学用语的书写,题目难度不大.

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案| A. | 臭氧 | B. | 二氧化氮 | C. | 二氧化硫 | D. | 二氧化碳 |
| A. | 纸层析法通常以滤纸作为惰性支持物.滤纸纤维上的羟基具有亲水性,它所吸附的水作固定相 | |
| B. | 重结晶时,溶质的溶解度越大、溶液冷却速度越慢,得到的晶体颗粒越小 | |
| C. | 硝酸钾饱和溶液冷却未出现结晶时,可以用玻棒充分磨擦器皿壁促使晶体析出 | |
| D. | 在牙膏的浸泡液中加入新制碱性Cu(OH)2,溶液变绛蓝色 |
| 实验操作 | 答案 | 实验现象 |
| (1)将浓硫酸滴在小木条上 | A.产生白烟 | |
| (2)将分别蘸有浓氨水和浓盐酸的玻璃棒靠近 | B.溶液褪色 | |
| (3)在盛有KI淀粉溶液的试管中滴加氯水 | C.溶液呈红色 | |
| (4)在盛有FeCl3溶液的试管中滴入2滴KSCN溶液 | D.产生棕红色气体 | |
| (5)铜丝放到浓硝酸中 | E.变黑色 | |
| (6)铜丝放入热的浓硫酸溶液中,将生成气体通入品红溶液中 | F.产生蓝色物质 |
| A. |  | B. |  | C. |  | D. |  |
| A. | 生成白色沉淀 | |
| B. | 生成红褐色沉淀 | |
| C. | 有气泡产生 | |
| D. | 先生成白色沉淀,迅速变成灰绿色,最后变成红褐色沉淀 |
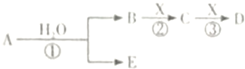 A、B、C、D、E是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分产物和反应条件略去):
A、B、C、D、E是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分产物和反应条件略去):