题目内容
12.按要求回答下列问题:(1)氯气与氢氧化钠在70℃时反应,生成物中NaClO3和NaClO的物质的量之比为3:1的离子方程式10Cl2+20OH-=16Cl-+3ClO3-+ClO-+10H2O
(2)①SO2通入足量Fe(NO3)3稀溶液中,溶液由棕色变为浅绿色;②随着反应的进行上述溶液立即又变为棕黄色,液面上有无色气体产生到试管口为红棕色②的离子方程式3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
(3)2K37ClO3+4H35Cl=2KCl+2ClO2↑+Cl2↑+2H2O在该条件下生成的氯气的摩尔质量为70g/mol.
分析 (1)Cl2与NaOH反应生成NaCl,Cl的化合价降低1价,生成NaClO3,Cl的化合价升高5价,根据得失电子守恒和原子守恒配平方程式;
(2)硝酸根离子在酸性条件下具有强氧化性,能氧化亚铁离子;
(3)K37ClO3中Cl元素的化合价由+5价降低为+4价,H35Cl中Cl元素的化合价由-1价升高为0.
解答 解:(1)Cl2与NaOH反应生成NaCl,Cl的化合价降低1价,生成NaClO3,Cl的化合价升高5价,生成NaClO,Cl的化合价升高1价,则反应的离子方程式为:10Cl2+20OH-=16Cl-+3ClO3-+ClO-+10H2O;
故答案为:10Cl2+20OH-=16Cl-+3ClO3-+ClO-+10H2O;
(2)硝酸根离子在酸性条件下具有强氧化性,能氧化亚铁离子,发生的反应有:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O;
故答案为:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O;
(3)K37ClO3中Cl元素的化合价由+5价降低为+4价,H35Cl中Cl元素的化合价由-1价升高为0,所以生成的氯气中的Cl原子全部来源于H35Cl,则35Cl2的摩尔质量为70g/mol;
故答案为:70g/mol.
点评 本题考查氧化还原反应,把握元素的化合价变化及电子守恒为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
2.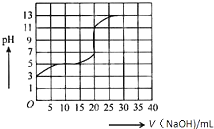 常温下,用0.50mol/L氢氧化钠溶液滴定某一元弱酸(HA)的溶液中,滴定曲线如图所示,下列叙述不正确的是( )
常温下,用0.50mol/L氢氧化钠溶液滴定某一元弱酸(HA)的溶液中,滴定曲线如图所示,下列叙述不正确的是( )
 常温下,用0.50mol/L氢氧化钠溶液滴定某一元弱酸(HA)的溶液中,滴定曲线如图所示,下列叙述不正确的是( )
常温下,用0.50mol/L氢氧化钠溶液滴定某一元弱酸(HA)的溶液中,滴定曲线如图所示,下列叙述不正确的是( )| A. | 该弱酸在滴定前的浓度大于0.001mol/L | |
| B. | 由滴定起点数据可计算该弱酸的Ka(电离平衡常数)为2×10-5 | |
| C. | 滴定过程为求滴定终点,最合适的指示剂是酚酞 | |
| D. | 滴定终点时,c(Na+)>c(A-)>c(OH-)>c(H+) |
20.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,2.24 L CO2与一定量的Na2O2反应转移的电子数目一定为0.1NA | |
| B. | C2H2、H2O2、Na2O2的最简式都可以用AB的形式表示 | |
| C. | 50 mL 12 mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| D. | 2.0 gH218O与D216O的混合物中所含中子数为NA |
7.下列说法正确的是( )
①硅在自然界中以游离态和化合态两种形式存在;
②SiO2是由1个Si原子和2个O原子形成的SiO2分子;
③水泥是硅酸盐材料;
④光导纤维的主要成分是Si单质;
⑤氮化硅陶瓷可做柴油机受热面的材料;
⑥水玻璃可以用作木材防火材料;
⑦硅胶可以做干燥剂;
⑧氢氟酸可以用来刻蚀玻璃.
①硅在自然界中以游离态和化合态两种形式存在;
②SiO2是由1个Si原子和2个O原子形成的SiO2分子;
③水泥是硅酸盐材料;
④光导纤维的主要成分是Si单质;
⑤氮化硅陶瓷可做柴油机受热面的材料;
⑥水玻璃可以用作木材防火材料;
⑦硅胶可以做干燥剂;
⑧氢氟酸可以用来刻蚀玻璃.
| A. | ①②③④⑤ | B. | ②③④⑥⑧ | C. | ③⑤⑥⑦⑧ | D. | ③④⑤⑥⑧ |
17.下列关于定量实验中的基本操作和仪器的描述正确的是( )
| A. | 用托盘天平称取20.00 g NaOH固体 | |
| B. | 向用水润湿的pH试纸上滴盐酸,可测定盐酸的pH | |
| C. | 用电子分析天平测得铁片质量是15.524 g | |
| D. | 在配制一定物质的量浓度的溶液时,定容后,经摇匀发现液面低于刻度线,此时再加入蒸馏水使其液面与刻度线持平 |
1.某兴趣小组的同学发现,将CuSO4溶液与K2CO3溶液混合会产生蓝绿色沉淀.他们对沉淀的组成很感兴趣,决定采用实验的方法进行探究.
(1)【提出假设】假设1:所得沉淀为Cu(OH)2;
假设2:所得沉淀为CuCO3;(填化学式)
假设3:所得沉淀为碱式碳酸铜[化学式可表示为mCu(OH)2•nCuCO3].
【查阅资料】无论是哪一种沉淀受热均易分解(假设均不含结晶水).
【定性探究】
步骤1:将所得悬浊液过滤,先用蒸馏水洗涤,再用无水乙醇洗涤,风干;
步骤2:甲同学取一定量固体,用气密性良好的如装置如图(夹持仪器未画)进行定性实验;
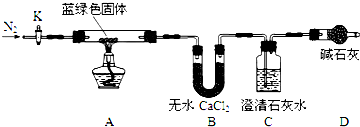
(2)若反应后A中蓝绿色固体变黑,C中无明显现象,证明假设1成立.
(3)乙同学认为只要将上图中B装置的试剂改用下列某试剂后,便可验证上述所有假设,该试剂是B(填代号).
A.浓硫酸 B.无水CuSO4 C.碱石灰 D.P2O5
(4)乙同学验证假设3成立的实验现象是A中蓝绿色固体变黑色,B中无水CuSO4固体变蓝,C中有白色沉淀产生.
【定量探究】
(5)乙同学进一步探究假设3中固体的组成:
①乙同学查得一些物质在常温时的数据(如下表)后,将C中的澄清石灰水改为Ba(OH)2溶液,其原因是AC(填代号).
A.Ba(OH)2溶解度大于Ca(OH)2,能充分吸收CO2
B.Ba(OH)2为强碱,Ca(OH)2为弱碱
C.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小
D.相同条件下,CaCO3的溶解度明显大于BaCO3
②若所取蓝绿色固体质量为27.1g,实验结束后,装置B的质量增加2.7g,C中产生沉淀的质量为19.7g.则该蓝绿色固体的化学式为2CuCO3•3Cu(OH)2、或3Cu(OH)2•2CuCO3或Cu5(OH)6(CO3)2;A中发生反应的化学方程式为2CuCO3•3Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$5CuO+3H2O↑+2CO2↑.
(1)【提出假设】假设1:所得沉淀为Cu(OH)2;
假设2:所得沉淀为CuCO3;(填化学式)
假设3:所得沉淀为碱式碳酸铜[化学式可表示为mCu(OH)2•nCuCO3].
【查阅资料】无论是哪一种沉淀受热均易分解(假设均不含结晶水).
【定性探究】
步骤1:将所得悬浊液过滤,先用蒸馏水洗涤,再用无水乙醇洗涤,风干;
步骤2:甲同学取一定量固体,用气密性良好的如装置如图(夹持仪器未画)进行定性实验;

(2)若反应后A中蓝绿色固体变黑,C中无明显现象,证明假设1成立.
(3)乙同学认为只要将上图中B装置的试剂改用下列某试剂后,便可验证上述所有假设,该试剂是B(填代号).
A.浓硫酸 B.无水CuSO4 C.碱石灰 D.P2O5
(4)乙同学验证假设3成立的实验现象是A中蓝绿色固体变黑色,B中无水CuSO4固体变蓝,C中有白色沉淀产生.
【定量探究】
(5)乙同学进一步探究假设3中固体的组成:
①乙同学查得一些物质在常温时的数据(如下表)后,将C中的澄清石灰水改为Ba(OH)2溶液,其原因是AC(填代号).
| 溶解度(S)/p | 溶度积(Ksp) | 摩尔质量(M)/g•mol-1 | |||
| Ca(OH)2 | Ba(OH)2 | CaCO3 | BaCO3 | CaCO3 | BaCO3 |
| 0.16 | 3.89 | 2.9×10-9 | 2.6×10-9 | 100 | 197 |
B.Ba(OH)2为强碱,Ca(OH)2为弱碱
C.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小
D.相同条件下,CaCO3的溶解度明显大于BaCO3
②若所取蓝绿色固体质量为27.1g,实验结束后,装置B的质量增加2.7g,C中产生沉淀的质量为19.7g.则该蓝绿色固体的化学式为2CuCO3•3Cu(OH)2、或3Cu(OH)2•2CuCO3或Cu5(OH)6(CO3)2;A中发生反应的化学方程式为2CuCO3•3Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$5CuO+3H2O↑+2CO2↑.
2.下列说法不正确的是( )
| A. | 乙醇分子中有1个氢原子与其他氢原子不一样 | |
| B. | 乙醇分子可认为是由乙烷分子中的一个-H被一个-OH取代产生的 | |
| C. | 乙醇分子中的每个碳原子都形成了四个共价键,但显示化合价不是+4价 | |
| D. | 乙醇的相对分子质量为46,相对分子质量为46的有机物就是乙醇 |
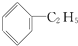 与
与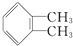
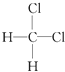 与
与
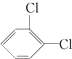 与
与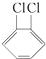
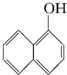 与
与
 或
或 .
.