题目内容
4.请完成如下“检验肥料硫酸铵中是否含有少量的氯化铵”的实验方法:(1)取少量肥料配成溶液,加入Ba(NO3)2(填化学式)溶液至沉淀不再产生,过滤(填实验操作名称);
(2)取(1)中生成的溶液于试管,滴加AgNO3(填化学式)溶液,若白色沉淀产生,则说明该肥料含有氯化铵;反之,则无.
分析 将少量肥料溶于水配成溶液,加入过量的硝酸钡,除去硫酸根离子,防止对氯离子的检验产生干扰,然后加过滤,向滤液中加入硝酸银,如果有白色沉淀说明有氯离子,由此分析解答.
解答 解:(1)将少量肥料溶于水配成溶液,加入过量的硝酸钡,除去硫酸根离子,防止对氯离子的检验产生干扰,然后加过滤,故答案为:Ba(NO3)2;过滤;
(2)向(1)中滤液中加入硝酸银,如果有白色沉淀说明有氯离子,则说明该肥料含有氯化铵;反之,则无,故答案为:AgNO3;白色沉淀.
点评 本题考查了物质的鉴别和除杂质,把握物质的性质差异为解答的关键,注意利用不同现象鉴别物质,题目难度不大.

练习册系列答案
相关题目
15.几种短周期元素的原子半径及化合价见表:
分析上表中有关数据,结合已学过的知识,回答以下问题.涉及上述元素的答案,请用元素符号表示.
(1)E元素在周期表中的位置是第3周期第ⅥA族.
(2)A、H、J对应的离子半径由大到小的顺序是(填写离子符号)F-、Na+、Al3+.
(3)用电子式表示A与I所形成化合物的形成过程 .
.
(4)B与H所形成的化合物与J的最高价氧化物的水化物X的溶液发生反应的离子方程式为Al2O3+3OH-=2AlO2-+H2O;
(5)用B与D所形成的化合物制备D单质的化学方程式为SiO2+2C$\frac{\underline{\;\;△\;\;}}{\;}$Si+2CO↑.
| 元素代号 | A | B | D | E | G | H | I | J |
| 化合价 | -1 | -2 | +4、-4 | +6、-2 | +5、-3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.130 | 0.102 | 0.110 | 0.143 | 0.160 | 0.186 |
(1)E元素在周期表中的位置是第3周期第ⅥA族.
(2)A、H、J对应的离子半径由大到小的顺序是(填写离子符号)F-、Na+、Al3+.
(3)用电子式表示A与I所形成化合物的形成过程
 .
.(4)B与H所形成的化合物与J的最高价氧化物的水化物X的溶液发生反应的离子方程式为Al2O3+3OH-=2AlO2-+H2O;
(5)用B与D所形成的化合物制备D单质的化学方程式为SiO2+2C$\frac{\underline{\;\;△\;\;}}{\;}$Si+2CO↑.
12.元素X、Y、Z的原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子排布.下列推测不正确的是( )
| A. | 同族元素中Z的氢化物稳定性最高 | |
| B. | 原子半径:X>Y,离子半径:X+>Z2- | |
| C. | 同周期元素中X的金属性最强 | |
| D. | 同周期元素中Y的最高价含氧酸的酸性最强 |
19.下列关于乙烯和聚乙烯的叙述中正确的是( )
| A. | 二者互为同系物 | |
| B. | 聚乙烯是乙烯的缩聚产物 | |
| C. | 二者都能使溴的四氯化碳溶液褪色 | |
| D. | 等质量的乙烯和聚乙烯分别完全燃烧消耗等物质的量的氧气,生成等量的水 |
9.下列有关石油和煤的利用叙述不正确的是( )
| A. | 煤的干馏就是将煤隔绝空气在高温使之分解,得到焦炭、煤焦油等物质的过程 | |
| B. | 煤的液化就是将煤转化成甲醇、乙醇等其液态物质的过程 | |
| C. | 煤的气化就是将煤在高温条件由固态转化为气态的物理变化过程 | |
| D. | 通过催化裂化或裂解,可以获得碳原子数较少的轻质油 |
16.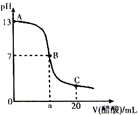 在20mL0.100mol•L-1NaOH溶液中逐滴加入0.200mol•L-1醋酸溶液,曲线如图所示,有关粒子浓度关系比较正确的是( )
在20mL0.100mol•L-1NaOH溶液中逐滴加入0.200mol•L-1醋酸溶液,曲线如图所示,有关粒子浓度关系比较正确的是( )
 在20mL0.100mol•L-1NaOH溶液中逐滴加入0.200mol•L-1醋酸溶液,曲线如图所示,有关粒子浓度关系比较正确的是( )
在20mL0.100mol•L-1NaOH溶液中逐滴加入0.200mol•L-1醋酸溶液,曲线如图所示,有关粒子浓度关系比较正确的是( )| A. | A点到B点的变化过程中,离子浓度大小关系:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 在B点a>10,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+) | |
| C. | B点到C点的变化过程中,离子浓度大小关系:c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | |
| D. | 在C点:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
13.下面是一些常见分子的比例模型.其中1个分子中含有共用电子对最多的是( )
| A. |  氢气 氢气 | B. |  氨气 氨气 | C. |  水 水 | D. |  二氧化碳 二氧化碳 |

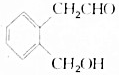 .A可以被新制Cu(OH)2氧化为B;B能在浓硫酸存在和加热时发生分子内的酯化反应生成C,C分子中有一个含氧的六元环.回答下列问题:
.A可以被新制Cu(OH)2氧化为B;B能在浓硫酸存在和加热时发生分子内的酯化反应生成C,C分子中有一个含氧的六元环.回答下列问题: .
.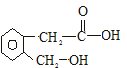 +Cu2O↓+2H2O.
+Cu2O↓+2H2O.