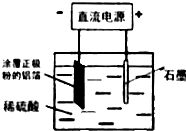
题目内容
16.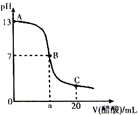 在20mL0.100mol•L-1NaOH溶液中逐滴加入0.200mol•L-1醋酸溶液,曲线如图所示,有关粒子浓度关系比较正确的是( )
在20mL0.100mol•L-1NaOH溶液中逐滴加入0.200mol•L-1醋酸溶液,曲线如图所示,有关粒子浓度关系比较正确的是( )| A. | A点到B点的变化过程中,离子浓度大小关系:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 在B点a>10,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+) | |
| C. | B点到C点的变化过程中,离子浓度大小关系:c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | |
| D. | 在C点:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
分析 A.A点到B点的变化过程中,若醋酸少量,则可能出现c(OH-)>c(CH3COO-);
B.氢离子和氢氧根离子浓度较小,则c(Na+)=c(CH3COO-)>c(OH-)=c(H+);
C.B点到C点的变化过程中,醋酸为弱酸,只能部分电离出氢离子,则c(Na+)>c(H+);
D.C点溶质为等浓度的醋酸和醋酸钠,根据物料守恒判断.
解答 解:A.A点到B点的变化过程中,当加入的醋酸较少时,离子浓度大小可能为:c(Na+)>c(OH-)>c(CH3COO-)>c(H+),故A错误;
B.B点为中性,则c(OH-)=c(H+)、c(Na+)=c(CH3COO-),当a=10时溶液的pH大于0,若为中性,则醋酸的体积稍大于10,且氢离子、氢氧根离子浓度较小,则正确的离子浓度大小为:c(Na+)=c(CH3COO-)>c(OH-)=c(H+),故B错误;
C.点到C点的变化过程中,溶液呈酸性,则c(H+)>c(OH-),由于醋酸为弱酸,只能部分电离出氢离子,则c(Na+)>c(H+),正确的离子浓度大小为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故C错误;
D.C点溶质为等浓度的醋酸和醋酸钠,根据物料守恒可得:c(CH3COO-)+c(CH3COOH)=2c(Na+),故D正确;
故选D.
点评 本题考查了离子浓度大小比较,题目难度中等,明确曲线变化对应反应为解答关键,注意掌握电荷守恒、物料守恒的含义及应用方法,试题培养了学生的灵活应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.根据海水综合利用的工业流程图(如图),判断下列说法正确的是( )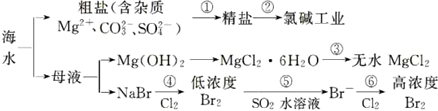

| A. | 过程①的提纯只有物理过程,过程②通过氧化还原反应可产生两种单质 | |
| B. | 在过程③中将MgCl2•6H2O真接灼烧即可制得纯净无水MgCl2 | |
| C. | 过程⑥所得的高浓度溴水只需分液即可获得液溴 | |
| D. | 过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀间题 |
7.已知维生素A的结构简式如下图,关于它的叙述中不正确的是( )


| A. | 维生素A的一个分子中有五个双键 | |
| B. | 维生素A是一种烯烃 | |
| C. | 维生素A能使溴水褪色,能被酸性KMnO4氧化 | |
| D. | 维生素A的一个分子中有30个氢原子 |
11.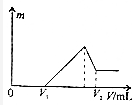 将0.1mol的镁、铝混合物溶于100mL2mol/LH2SO4溶液中,然后再滴加1mol/LNaOH溶液.若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示.当V2=460mL时,则原混合物中镁铝的质量比是( )
将0.1mol的镁、铝混合物溶于100mL2mol/LH2SO4溶液中,然后再滴加1mol/LNaOH溶液.若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示.当V2=460mL时,则原混合物中镁铝的质量比是( )
 将0.1mol的镁、铝混合物溶于100mL2mol/LH2SO4溶液中,然后再滴加1mol/LNaOH溶液.若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示.当V2=460mL时,则原混合物中镁铝的质量比是( )
将0.1mol的镁、铝混合物溶于100mL2mol/LH2SO4溶液中,然后再滴加1mol/LNaOH溶液.若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示.当V2=460mL时,则原混合物中镁铝的质量比是( )| A. | 1:1 | B. | 2:3 | C. | 16:27 | D. | 8:9 |
8.下列有关实验操作、现象和解释或结论都正确的是( )
| 选项 | 实验操作与现象 | 解释或结论 |
| A | 过量的铁粉中加入稀硝酸中,充分反应后,滴入KSCN溶液,溶液呈红色 | 稀硝酸将Fe氧化为Fe3+ |
| B | AgI固体中滴入KCl溶液,沉淀由黄色变为白色 | AgI比AgCl难溶 |
| C | 铝箔插入稀硝酸中,无现象 | 铝箔表面被硝酸氧化,形成致密的氧化膜 |
| D | 苯酚溶液中滴加溴水,出现白色沉淀 | 苯酚易发生取代反应 |
| A. | A | B. | B | C. | C | D. | D |
5.某氯原子的质量是a g,12C原子的质量是bg,用NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | 氯元素的相对原子质量为$\frac{12b}{a}$ | |
| B. | mg该氯原子的物质的量一定是$\frac{m}{(a{N}_{A})}$mol | |
| C. | 该氯元素的摩尔质量是aNA | |
| D. | ng该氯原子所含的电子数为$\frac{n}{a}$ |
6.CH2=CH2(g)+O2(g)═2 (g)△H=-106kJ•mol-1
(g)△H=-106kJ•mol-1
其反应机理如下:
①Ag+O2→AgO2 慢
②CH2=CH2+AgO2→ +AgO 快
+AgO 快
③CH2=CH2+6AgO→2CO2+2H2O+6Ag 快
下列有关该反应的说法正确的是( )
 (g)△H=-106kJ•mol-1
(g)△H=-106kJ•mol-1其反应机理如下:
①Ag+O2→AgO2 慢
②CH2=CH2+AgO2→
 +AgO 快
+AgO 快③CH2=CH2+6AgO→2CO2+2H2O+6Ag 快
下列有关该反应的说法正确的是( )
| A. | 反应的活化能等于106kJ•mol-1 | |
| B. | AgO2也是反应的催化剂 | |
| C. | 增大乙烯浓度能显著提高环氧乙烷的生成速率 | |
| D. | 理论上0.7mol乙烯参与反应最多可得到0.6mol环氧乙烷 |