题目内容
上课了,老师展示了三瓶无色溶液,并告诉同学们它们分别是NaCl溶液、NaBr溶液和NaI溶液,下面就和老师一起去研究这些溶液.
(1)老师取溶液少许分别加入试管中,然后分别通入氯气.同学们看到的现象是NaCl溶液无变化,NaBr溶液、NaI溶液分别变为橙色和褐色.有关反应的化学方程式分别是 、 .这一现象说明的问题是 .
(2)老师又取溶液少许分别加入试管中,然后分别滴加溴水.同学们看到的现象是NaCl溶液、NaBr溶液无变化,NaI溶液褐色.化学方程式是 .这一现象说明的问题是 .综合分析(1)和(2)得出的结论是 .
(1)老师取溶液少许分别加入试管中,然后分别通入氯气.同学们看到的现象是NaCl溶液无变化,NaBr溶液、NaI溶液分别变为橙色和褐色.有关反应的化学方程式分别是
(2)老师又取溶液少许分别加入试管中,然后分别滴加溴水.同学们看到的现象是NaCl溶液、NaBr溶液无变化,NaI溶液褐色.化学方程式是
考点:物质的检验和鉴别的实验方案设计
专题:物质检验鉴别题
分析:(1)分别通入氯气,NaCl溶液无变化,NaBr溶液、NaI溶液分别变为橙色和褐色,则氯气能氧化碘离子、溴离子,分别生成碘、溴;
(2)然后分别滴加溴水,NaCl溶液、NaBr溶液无变化,NaI溶液褐色,则溴可氧化碘离子,以此来解答.
(2)然后分别滴加溴水,NaCl溶液、NaBr溶液无变化,NaI溶液褐色,则溴可氧化碘离子,以此来解答.
解答:
解:(1)分别通入氯气,NaCl溶液无变化,NaBr溶液、NaI溶液分别变为橙色和褐色,则氯气能氧化碘离子、溴离子,分别生成碘、溴,发生的反应为Cl2+2NaBr=2NaCl+Br2、Cl2+2NaI=2NaCl+I2,该实验说明氯气能从NaBr、NaI溶液中置换出单质Br2、I2,
故答案为:Cl2+2NaBr=2NaCl+Br2;Cl2+2NaI=2NaCl+I2;氯气能从NaBr、NaI溶液中置换出单质Br2、I2;
(2)然后分别滴加溴水,NaCl溶液、NaBr溶液无变化,NaI溶液褐色,则溴可氧化碘离子,发生的反应为Br2+2NaI=2NaBr+I2,该实验现象说明溴能从NaI溶液中置换出I2,则由(1)和(2)得出的结论是氧化性为Cl2>Br2>I2,
故答案为:Br2+2NaI=2NaBr+I2;溴能从NaI溶液中置换出I2;氧化性为Cl2>Br2>I2.
故答案为:Cl2+2NaBr=2NaCl+Br2;Cl2+2NaI=2NaCl+I2;氯气能从NaBr、NaI溶液中置换出单质Br2、I2;
(2)然后分别滴加溴水,NaCl溶液、NaBr溶液无变化,NaI溶液褐色,则溴可氧化碘离子,发生的反应为Br2+2NaI=2NaBr+I2,该实验现象说明溴能从NaI溶液中置换出I2,则由(1)和(2)得出的结论是氧化性为Cl2>Br2>I2,
故答案为:Br2+2NaI=2NaBr+I2;溴能从NaI溶液中置换出I2;氧化性为Cl2>Br2>I2.
点评:本题考查物质检验实验方案的设计,为高频考点,把握现象与发生的氧化还原反应的关系为解答的关键,侧重分析与实验能力的考查,注意氧化还原反应原理的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
X、Y、Z是原子序数依次增大且属于不同周期的三种常见短周期元素,三种元素相互之间可以形成1:1型的化合物R、M、N,常温下M、N为固体,R为液体.M、N遇到水都能产生气体,而且产生的气体相互可以化合,下列说法正确的是( )
| A、三种元素都是非金属元素 |
| B、由三种元素形成的物质既含离子键又含共价键 |
| C、三种化合物都是共价化合物 |
| D、各1mol的M、N与水反应所得气体体积比为1:1 |
某无色溶液中只可能含有Na+、K+、Fe3+、NH4+、Cu2+、SO42-、SO32-、CO32-、Cl-、Br-这几种离子中的若干种,依次进行下列实验,观察到的现象记录如下:
①pH试纸检验,溶液呈碱性;
②取少量原溶液,向溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成.
③另取少量原溶液,向溶液中滴加足量氯水,再加入CCl4振荡,静置后CCl4层呈橙红色.
④向分液后的水溶液中加入Ba(NO3)2溶液和HNO3溶液,有白色沉淀产生,过滤.
⑤在滤液中加入AgNO3和HNO3的混合溶液有白色沉淀产生.则关于原溶液的判断中不正确的是( )
①pH试纸检验,溶液呈碱性;
②取少量原溶液,向溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成.
③另取少量原溶液,向溶液中滴加足量氯水,再加入CCl4振荡,静置后CCl4层呈橙红色.
④向分液后的水溶液中加入Ba(NO3)2溶液和HNO3溶液,有白色沉淀产生,过滤.
⑤在滤液中加入AgNO3和HNO3的混合溶液有白色沉淀产生.则关于原溶液的判断中不正确的是( )
| A、肯定不存在的离子是Fe3+、Cu2+、NH4+、SO42-、CO32- |
| B、肯定存在的离子是Na+、K+、CO32-、Br- |
| C、无法确定原溶液中是否存在Cl- |
| D、若步骤④改用BaCl2溶液和盐酸的混合溶液,则对溶液中离子的判断无影响 |
海水中含有丰富的氯元素,这些氯元素( )
| A、处于化合态 | B、处于游离态 |
| C、是单质 | D、显正价 |
下列关于氮的说法正确的是( )
| A、N2分子的结构较稳定,因而氮气不能支持任何物质燃烧 |
| B、23gNO2和N2O4混合气含有0.5NA个氮原子(NA表示阿伏加德罗常数) |
| C、检验NH4+存在时,用湿润的蓝色石蕊试纸 |
| D、浓硝酸保存在棕色瓶内是因为硝酸易挥发 |
下列说法正确的是( )
| A、SO2能使FeCl3、KMnO4溶液褪色 |
| B、用澄清石灰水可鉴别CO2和SO2 |
| C、S在O2中燃烧可生成SO3 |
| D、SO2通人BaCl2溶液中能产生白色沉淀 |

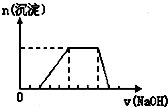 某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是