题目内容
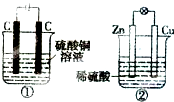 如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol/L,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )
如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol/L,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )| A、产生气体体积:①=② |
| B、溶液的pH变化:①减小,②增大 |
| C、电极反应式:①中阳极为4 OH--4e-=2H2O+O2↑②中负极为2H++2e-=H2↑ |
| D、①中阴极质量增加,②中正极质量减小 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:①为电解池,阳极上氢氧根离子放电生成氧气,阴极上铜离子放电生成铜;
②为原电池,锌失电子作负极,铜作正极,负极上锌失电子发生氧化反应,正极上氢离子得电子发生还原反应.
②为原电池,锌失电子作负极,铜作正极,负极上锌失电子发生氧化反应,正极上氢离子得电子发生还原反应.
解答:
解:A.①中阳极上生成氧气,②中正极上生成氢气,当转移电子相等为0.02mol时,生成氧气体积=
×22.4L/mol=0.112L,生成氢气体积=
×22.4L/mol=0.224L,故A错误;
B.①中溶液有氢离子生成,溶液酸性增强,②中有氢氧根离子生成,溶液碱性增强,所以溶液的pH变化:①减小,②增大,故B正确;
C.电极反应式为:①中阳极为4 OH--4e-=2H2O+O2↑,②中负极为Zn-2e-=Zn2+,故C错误;
D.①中阴极上析出铜,②中正极上生成氢气导致电极质量不变,故D错误;
故选B.
| 0.02mol |
| 4 |
| 0.02mol |
| 2 |
B.①中溶液有氢离子生成,溶液酸性增强,②中有氢氧根离子生成,溶液碱性增强,所以溶液的pH变化:①减小,②增大,故B正确;
C.电极反应式为:①中阳极为4 OH--4e-=2H2O+O2↑,②中负极为Zn-2e-=Zn2+,故C错误;
D.①中阴极上析出铜,②中正极上生成氢气导致电极质量不变,故D错误;
故选B.
点评:本题考查了原电池和电解池原理,根据各个电极上电极反应及转移电子来分析解答,难点是电极反应式的书写,题目难度不大.

练习册系列答案
相关题目
NA表示阿伏加德罗常数,下列说法正确的是( )
| A、标准状况下,11.2L SO3含有0.5NA SO3分子 |
| B、7.8g Na2O2与足量CO2反应,转移的电子数为0.1NA |
| C、1mol C5H12中含有的共价键数为17NA |
| D、1L 0.1mol?L-1的Na2S溶液中含有0.1NA S2-离子 |
 如图为化学兴趣小组制作的番茄电池,下列说法正确的是( )
如图为化学兴趣小组制作的番茄电池,下列说法正确的是( )| A、负极反应式为:Cu-2e-=Cu2+ |
| B、一段时间后,锌片质量会变小 |
| C、电子由铜通过导线流向锌 |
| D、锌电极是该电池的正极 |
无色的有机物Ⅰ是印制防伪商标的一种原料,在紫外光辐射下I可转变成结构Ⅱ(显橙色),反应如下(R1、R2、R3是烃基):

有关上述变化的说法正确的是( )

有关上述变化的说法正确的是( )
| A、Ⅰ属于芳香烃 |
| B、被Cl2熏蒸过的商标将失去防伪能力 |
| C、Ⅰ和Ⅱ互为同分异构体 |
| D、若R1、R2、R3都是甲基,Ⅱ的分子是C26H24O3 |
衡水市热电厂每年需燃烧大量的原煤用来发电,其中煤的脱硫是一个必要环节,它所起的主作用是防止
( )
( )
| A、酸雨加剧 |
| B、温室效应 |
| C、白色污染 |
| D、光化学烟雾的形成 |
某粒子用符号AZM n+表示,下列关于该粒子的叙述正确的是( )
| A、所含质子数为(A-n) |
| B、所含中子数为(A-Z) |
| C、所含电子数为(Z+n) |
| D、该粒子比M原子多n个电子 |
 已知化合物B3N3H6(硼氮苯)与苯的分子结构相似,如图所示,则硼氮苯的四氯取代物(B3N3H2Cl4)的同分异构体的数目为( )
已知化合物B3N3H6(硼氮苯)与苯的分子结构相似,如图所示,则硼氮苯的四氯取代物(B3N3H2Cl4)的同分异构体的数目为( )