题目内容
 如图为化学兴趣小组制作的番茄电池,下列说法正确的是( )
如图为化学兴趣小组制作的番茄电池,下列说法正确的是( )| A、负极反应式为:Cu-2e-=Cu2+ |
| B、一段时间后,锌片质量会变小 |
| C、电子由铜通过导线流向锌 |
| D、锌电极是该电池的正极 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:根据金属的活泼性知,锌作负极,铜作正极,负极上锌失电子发生氧化反应,正极上得电子发生还原反应,电子从负极沿导线流向正极,电流从正极沿导线流向负极.
解答:
解:A.锌为负极,负极方程式为Zn-2e-=Zn2+,故A错误;
B.该原电池中,锌作负极,负极上锌失电子生成锌离子进入溶液,所以锌片的质量会变小,故B正确;
C.锌作负极,铜作正极,电子从锌经导线流向铜,故C错误;
D.锌作该原电池的负极,故D错误;
故选B.
B.该原电池中,锌作负极,负极上锌失电子生成锌离子进入溶液,所以锌片的质量会变小,故B正确;
C.锌作负极,铜作正极,电子从锌经导线流向铜,故C错误;
D.锌作该原电池的负极,故D错误;
故选B.
点评:本题考查原电池知识,为高频考点,侧重于学生的分析能力的考查,题目贴近生活,难度适中,有利于培养学生的良好的科学素养、提高学生的学习积极性,难度不大.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目
下列表示对应化学反应的离子方程式正确的是( )
| A、FeBr2溶液中通入少量Cl2:2Fe2++Cl2=2Fe3++2Cl- |
| B、FeCl3溶液与Cu反应:Cu+Fe3+=Cu2++Fe2+ |
| C、醋酸溶解水垢中的CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ |
| D、向Na[Al(OH)4]溶液中通入过量CO2:2[Al(OH)4]-+CO2=2Al(OH)3↓+CO32-+H2O |
常温下,物质的量浓度均为0.01mol?L-1的醋酸溶液和盐酸,下列说法正确的是( )
| A、两溶液的pH相同 |
| B、分别加入足量锌片,盐酸生成的H2体积大 |
| C、分别稀释100倍后,醋酸浓度与盐酸浓度相等 |
| D、由水电离出的氢离子浓度均为1×10-12mol?L-1 |
 如图是某只含有C、H、O、N的有机物简易球棍模型.下列关于该有机物的说法错误的是( )
如图是某只含有C、H、O、N的有机物简易球棍模型.下列关于该有机物的说法错误的是( )| A、该有机物的分子式为C3H7O2N |
| B、该有机物的名称为α氨基丙酸 |
| C、该有机物能发生加成反应 |
| D、该有机物能发生酯化反应 |
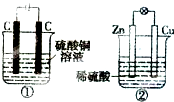 如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol/L,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )
如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol/L,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )| A、产生气体体积:①=② |
| B、溶液的pH变化:①减小,②增大 |
| C、电极反应式:①中阳极为4 OH--4e-=2H2O+O2↑②中负极为2H++2e-=H2↑ |
| D、①中阴极质量增加,②中正极质量减小 |
某学生欲完成反应Cu+H2SO4═CuSO4+H2↑而设计了下列四个实验,你认为可行的是( )
A、 H2SO4 |
B、 H2SO4 |
C、 H2SO4 |
D、 H2SO4 |
下列说法不正确的是( )
| A、绿色化学的核心就是如何对被污染的环境进行无毒无害的治理 |
| B、形成酸雨的主要物质是硫的氧化物和氮的氧化物 |
| C、从海水中可以得到MgCl2,电解熔融MgCl2可制备Mg |
| D、水华、赤潮等水体污染主要是由含氮、磷的生活污水任意排放造成的 |
