题目内容
硫化钠主要用于皮革、毛纺、高档纸张、染料等行业。生产硫化钠大多采用无水芒硝(Na2SO4)—炭粉还原法,其流程示意图如下:
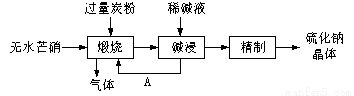
(1)上述流程中“碱浸”后,物质A必须经过 (填写操作名称)处理后,方可“煅烧”;若煅烧所得气体为等物质的量的CO和CO2,写出煅烧时发生的总的化学反应方程式为 。
(2)上述流程中采用稀碱液比用热水更好,理由是稀碱液能 Na2S水解(选促进或抑制)
(3)取硫化钠晶体(含少量NaOH)加入到硫酸铜溶液中,充分搅拌。若反应后测得溶液的pH=4,则此时溶液中c( S2-)= mol·L-1。(已知:常温时CuS、Cu(OH)2的Ksp分别为8.8×10-36、2.2×10-20)
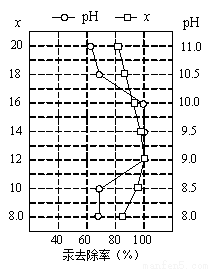
(4)①皮革工业废水中的汞常用硫化钠除去,汞的去除率与溶液的pH和x(x代表硫化钠的实际用量与理论用量的比值)有关(如右图所示)。为使除汞效果最佳,应控制的条件是x控制 、pH控制 。
②某毛纺厂废水中含0.001 mol·L-1的硫化钠,与纸张漂白后的废水(含0.002 mol·L-1 NaClO)按1:2的体积比混合,能同时较好处理两种废水,处理后的废水中所含的主要阴离子有 。
练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温下,0.5mo1•L-1Fe2(SO4)3溶液中含Fe3+数目为1NA | |
| B. | 标准状况下,22.4L苯中含C-H数目为6NA | |
| C. | 常温常压下,16gO2和O3混合气体中,含氧原子的总数为1NA | |
| D. | 5.6gFe与足量稀盐酸反应,转移电子数为0.3NA |
13.原电池是能把化学能转变成电能的装置,下列关于Zn-Cu(H2SO4)原电池的说法中错误的是( )
| A. | 负极:Zn-2e-═Zn2+(氧化反应) | B. | 正极:O2+2H2O+4e-═4OH-(还原反应) | ||
| C. | 电流流向:Cu→Zn | D. | 正极:2H++2e-═H2↑(还原反应) |


 、NO3-、SO42- D.H+、Na+、HCO3-、NO3-
、NO3-、SO42- D.H+、Na+、HCO3-、NO3-
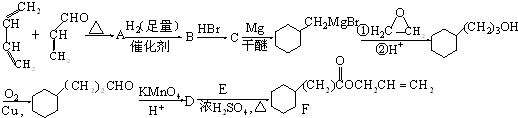
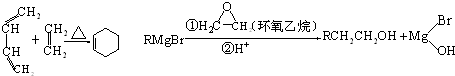
 ,A中所含官能团的名称是醛基、碳碳双键.
,A中所含官能团的名称是醛基、碳碳双键. .
. .
.