题目内容
下列反应的离子方程式书写正确的是
A.铜和醋酸反应:Cu+2CH3COOH 2CH3COO-+Cu2++H2↑
2CH3COO-+Cu2++H2↑
B.氧化铁与稀盐酸反应:Fe2O3+6H+ 2Fe3++3H2O
2Fe3++3H2O
C.锌与硝酸银溶液反应:Zn+Ag+ Zn2++Ag
Zn2++Ag
D.稀硝酸和石灰乳反应:H++OH- H2O
H2O
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.下列说法不正确的是( )
| A. | 常温下,用pH计测量0.1mol•L-1FeCl3溶液的pH为a,再测量稀释10倍的0.01mol•L-1FeCl3溶液的pH为b,可判断出FeCl3水解程度与盐溶液浓度大小关系 | |
| B. | 将装有3~4mL无水乙醇的试管浸入50℃左右的热水中,将烧黑的铜丝迅速插入无水乙醇中,可观察到铜丝变红,反复数次,可闻到刺激性气味 | |
| C. | 向某溶液加浓NaOH溶液并微热,若产生的气体能使湿润的红色石蕊试纸变蓝,则说明此溶质为铵盐 | |
| D. | 酸碱中和滴定到终点读数时,发现滴定管尖嘴处悬挂一滴标准溶液,导致实验结果偏高 |
19.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温下,0.5mo1•L-1Fe2(SO4)3溶液中含Fe3+数目为1NA | |
| B. | 标准状况下,22.4L苯中含C-H数目为6NA | |
| C. | 常温常压下,16gO2和O3混合气体中,含氧原子的总数为1NA | |
| D. | 5.6gFe与足量稀盐酸反应,转移电子数为0.3NA |
| 成分的质量/g | 摩尔质量/(g•mol-1?) |
蔗糖 | 25.00 | 342 |
硫酸钾 | 0.87 | 174 |
阿司匹林 | 0.17 | 180 |
高锰酸钾 | 0.316 | 158 |
硝酸银 | 0.02 | 170 |
(1)下列“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为__________mol•L-1(要求:用原始数据写出表达式即可,不需要化简与计算)。
(2)配制上述“鲜花保鲜剂”所需的仪器有烧杯、玻璃棒、药匙、托盘天平(带砝码)、
____________________(填所缺仪器的名称)。
(3)在溶液配制过程中,下列操作对配制结果没有影响的是_________(填字母).
A.定容时,俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(4)若要配制0.5mol·L-1500ml的硫酸溶液,则:
①所需质量分数为98%、密度为1.84g·cm-3的浓硫酸的体积为___________(计算结果保留一位小数)mL;
②如果实验室有15mL、20mL、50mL量筒,应选用___________mL量筒最好;
③配制过程中需先在烧杯中将浓硫酸稀释,稀释时操作方法是_____________________.


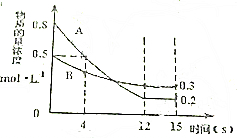 已知:反应aA(g)+bB(g)?cC(g)某温度下,在2L的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示.
已知:反应aA(g)+bB(g)?cC(g)某温度下,在2L的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示. 法并无不妥,甚至可以说并不是害人而是救人.那么,这种做法的化学原理是
法并无不妥,甚至可以说并不是害人而是救人.那么,这种做法的化学原理是