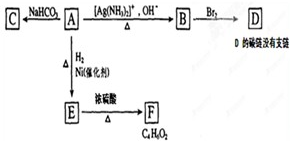
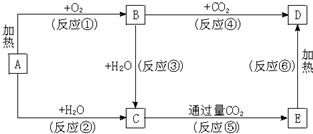
题目内容
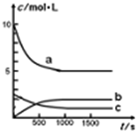 一定温度下,在体积为1L的恒容密闭容器中充入10mol NO2和2.5molO2发生反应:4NO2(g)+O2(g)?2N2O5(g)△H<0.反应混合物中NO2和物质的量浓度随时间的变化如表所示:
一定温度下,在体积为1L的恒容密闭容器中充入10mol NO2和2.5molO2发生反应:4NO2(g)+O2(g)?2N2O5(g)△H<0.反应混合物中NO2和物质的量浓度随时间的变化如表所示:| t/s | 0 | 500 | 1000 | 1500 |
| c(NO2)/mol?L-1 | 10 | 7 | 5 | 5 |
(2)反应达到平衡时,NO2的转化率为
A.降低温度 B.充入氦气
C.再充入NO2 D.充入O2
(3)图中表示N2O5的浓度的变化曲线是
考点:物质的量或浓度随时间的变化曲线,化学平衡的影响因素
专题:化学平衡专题
分析:(1)△H<0,正反应方向放热;化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值;
(2)利用反应达到平衡时,NO2的浓度变化量与起始浓度的比值计算转化率;使化学平衡向右移动,可提高转化率;
(3)化学平衡从正反应方向建立,即N2O5的浓度增大,判断表示N2O5的浓度的变化曲线.
(2)利用反应达到平衡时,NO2的浓度变化量与起始浓度的比值计算转化率;使化学平衡向右移动,可提高转化率;
(3)化学平衡从正反应方向建立,即N2O5的浓度增大,判断表示N2O5的浓度的变化曲线.
解答:
解:(1)△H<0,正反应方向放热;化学平衡常数表达式K=
,故答案为:放热、
;
(2)反应达到平衡时,NO2的浓度减小了10mol?L-1-5mol?L-1=5mol?L-1,起始浓度为10mol?L-1,则NO2的转化率为:
×100%=50%;
增大NO2的转化率,即化学平衡向右移动,
A.降低温度,化学平衡向放热方向移动,正反应放热,可提高转化率,故A正确;
B.充入氦气,化学平衡不移动,NO2的转化率不变,故B错误;
C.再充入NO2 ,虽然使化学平衡向右移动,但是起始时NO2的浓度也增大,且转化的NO2的浓度增大量小于起始浓度增大量,即NO2的转化率减小,故C错误;
D.充入O2,化学平衡向右移动,转化率增大,故D正确;
故选:AD;
(3)化学平衡从正反应方向建立,即N2O5的浓度增大,图中只有b增大,故答案为:b.
| c2(N2O5) |
| c4(NO2)?c(O2) |
| c2(N2O5) |
| c4(NO2)?c(O2) |
(2)反应达到平衡时,NO2的浓度减小了10mol?L-1-5mol?L-1=5mol?L-1,起始浓度为10mol?L-1,则NO2的转化率为:
| 5mol?L-1 |
| 10mol?L-1 |
增大NO2的转化率,即化学平衡向右移动,
A.降低温度,化学平衡向放热方向移动,正反应放热,可提高转化率,故A正确;
B.充入氦气,化学平衡不移动,NO2的转化率不变,故B错误;
C.再充入NO2 ,虽然使化学平衡向右移动,但是起始时NO2的浓度也增大,且转化的NO2的浓度增大量小于起始浓度增大量,即NO2的转化率减小,故C错误;
D.充入O2,化学平衡向右移动,转化率增大,故D正确;
故选:AD;
(3)化学平衡从正反应方向建立,即N2O5的浓度增大,图中只有b增大,故答案为:b.
点评:本题考查化学平衡图象、化学平衡常数表达式、反应物转化率的计算、影响平衡移动的因素等,难度不大.

练习册系列答案
相关题目
海洋约占地球表面积的71%,对其进行开发利用的部分流程如图所示.下列说法错误的是( )


| A、试剂1可以选用石灰乳 |
| B、从苦卤中提取Br2的反应的离子方程式为:2Br-+Cl2═2Cl-+Br2 |
| C、工业上,电解熔融MgO冶炼金属镁可减小能耗 |
| D、可用BaCl2溶液除去粗盐中的SO42- |
2007年度诺贝尔化学奖,授予致力于研究合成氨与催化剂表面积大小关系的德国科学家格哈德?埃特尔,表彰他在“固体表面化学过程”研究中作出的贡献.下列说法中正确的是( )
| A、工业生产中,合成氨采用压强越高,温度越低,越有利于提高经济效益 |
| B、增大催化剂的表面积,能加快合成氨的正反应速率、降低逆反应速率 |
| C、采用催化剂时,反应的活化能降低,使反应易达过渡态,故明显加快 |
| D、增大催化剂的表面积,能增大氨气的产率 |
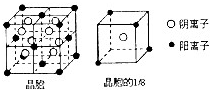 A、B、C、D、E都是元素周期表中前20号元素,其原子序数依次增大.B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族.B、C、D的最高价氧化物的水化物均能互相反应生成盐和水,D的原子半径是同周期原子中最小的.
A、B、C、D、E都是元素周期表中前20号元素,其原子序数依次增大.B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族.B、C、D的最高价氧化物的水化物均能互相反应生成盐和水,D的原子半径是同周期原子中最小的.