题目内容
20.将3.9g镁铝合金,投入到500mL 2mol/L的盐酸中,金属完全溶解,再加入4mol/L的NaOH溶液,若要生成的沉淀最多,加入的这种NaOH溶液的体积是( )| A. | 125 mL | B. | 200 mL | C. | 250 mL | D. | 560 mL |
分析 镁铝合金与盐酸反应,金属完全溶解,反应生成MgCl2、AlCl3,加入4mol/L的NaOH溶液,生成的沉淀最多时,Mg2+和Al3+全部转化为沉淀,溶液中的溶质只有NaCl,根据氯原子和钠原子守恒,可得n(NaOH)=n(NaCl)=n(HCl),再根据V=$\frac{n}{c}$计算.
解答 解:镁铝合金与盐酸反应,金属完全溶解,反应生成MgCl2、AlCl3,加入4mol/L的NaOH溶液,生成的沉淀最多时,Mg2+和Al3+全部转化为沉淀,溶液中的溶质只有NaCl,根据氯原子和钠原子守恒,可得n(NaOH)=n(NaCl)=n(HCl)=2mol/L×0.5L=1mol,故需要氢氧化钠溶液体积=$\frac{1mol}{4mol/L}$=0.25L=250mL,
故选C.
点评 本题考查混合物计算,难度中等,注意Mg2+和Al3+全部转化为沉淀时,NaOH不能过量,溶液中的溶质只有NaCl,注意利用原子守恒解答.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
10.在含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.01mol的混合溶液中加入0.01mol铁粉,经搅拌后发生的变化应是( )
| A. | 铁溶解,析出0.01molAg和0.005 molCu | |
| B. | 铁溶解,析出0.01molAg并放出H2 | |
| C. | 铁溶解,析出0.01molAg,溶液中不再有Fe3+ | |
| D. | 铁溶解,析出0.01molAg,溶液中不再有Cu2+ |
11.下列溶液中各微粒的浓度关系正确的是( )
| A. | NH4Cl溶液中:c(Cl-)=c(NH4+)>c(OH-)=c(H+) | |
| B. | Na2SO4溶液中:c(Na+)+c(H+)=c(SO42-)+c(OH-) | |
| C. | NaHCO3溶液中:c(Na+)>c(HCO3-)>c(H+)>c(OH-) | |
| D. | 等体积、等物质的量浓度的CH3COONa和弱酸CH3COOH混合后的溶液中:c(CH3COO-)-c(CH3COOH)=2c(H+)-2c(OH-) |
8.下列说法不正确的是( )
| A. | σ键比π键重叠程度大,形成的共价键强 | |
| B. | 两个原子之间形成共价键时,只能形成一个σ键 | |
| C. | 气体单质中,一定有σ键,可能有π键 | |
| D. | N2分子中一个σ键,两个π键 |
15.下列说法中正确的是( )
| A. | 升高温度能够增加活化分子的总数 | |
| B. | 增大反应物浓度能够增加活化分子的百分数 | |
| C. | 加入催化剂可以使本来不能发生的反应发生化学反应 | |
| D. | 压强影响所有化学反应的速率 |
5.在120℃时,在一密闭容器中有CO、H2、O2混合气体共28.5g,用电火花引燃,使其完全燃烧,再将燃烧后的气体用过量的Na2O2充分吸收,固体增重12.5g,则原混合气体中O2的物质的量是( )
| A. | 0.35mol | B. | 0.45 mol | C. | 0.50 mol | D. | 1.00mol |
12.下列有关物质性质的应用正确的是( )
| A. | 液氨汽化时要吸收大量的热,可用作制冷剂 | |
| B. | SiO2既能与HF反应,又能与NaOH反应,属于两性氧化物 | |
| C. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 氯化铝是一种电解质,可用于电解制铝 |
9.化学与新型材料、环境保护、能源开发等密切相关.下列说法正确的是( )
| A. | 人造纤维、合成橡胶和光导纤维都属于有机高分子化合物 | |
| B. | 推广燃煤发电,停建核电站,以防核泄漏事故发生 | |
| C. | 设计绿色化工工艺,提高反应的选择性和原子利用率 | |
| D. | 棉花和木材的主要成分都是纤维素,蚕丝和人造丝的主要成分都是蛋白质 |
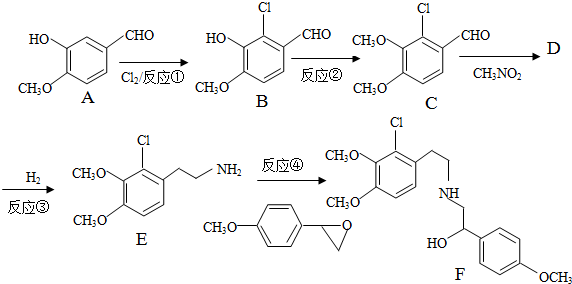
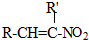 +H2O
+H2O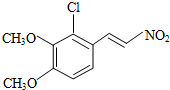 ,反应③中1摩尔D需要4摩尔H2才能转化为E
,反应③中1摩尔D需要4摩尔H2才能转化为E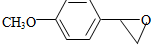 很多种同分异构体,请写出符合下列条件的一种同分异构体的结构简式
很多种同分异构体,请写出符合下列条件的一种同分异构体的结构简式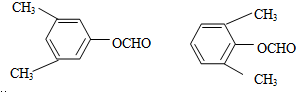 .
.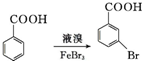 .写出以
.写出以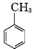 为原料制备
为原料制备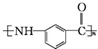 的合成路线流程图(无机试剂任选).(合成路线常用表示方法为:A$→_{反应试剂}^{反应试剂}$B …$→_{反应试剂}^{反应试剂}$目标产物)
的合成路线流程图(无机试剂任选).(合成路线常用表示方法为:A$→_{反应试剂}^{反应试剂}$B …$→_{反应试剂}^{反应试剂}$目标产物)