题目内容
 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:(1)W在周期表中的位置是
(2)元素的原子得电子能力:Q
(3)原子序数比R多8的元素形成的一种常见气态氢化物的沸点
(4)现有8种元素的性质、数据如下表所列,它们属于短周期:请指出R元素在下表中的对应编号
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.6 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
考点:位置结构性质的相互关系应用,元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:图中所示是短周期元素Q、R、T、W在元素周期表中的位置,因为T所处的周期序数与主族族序数相等,所以可以知道T是Al,Q是C,R是N,W是S,据此解答各小题即可.
解答:
解:T所处的周期序数与主族族序数相等,则T为Al,结合位置可知:Q是C,R是N,W是S,
(1)W为S,S有3个电子层,最外层6个电子,故处于第三周期ⅥA族,电子层数越多,半径越大,同一周期原子序数越小,半径越大,故C、N、Al三种元素原子的半径从大到小排列顺序Al>C>N,C的最高价氧化物为二氧化碳,CO2中C与O形成两对共价键,故电子式为 ,R为N,N的气态氢化物为NH3,NH3的结构式为
,R为N,N的气态氢化物为NH3,NH3的结构式为 ,故答案为:第三周期ⅥA族; Al>C>N;
,故答案为:第三周期ⅥA族; Al>C>N;  ;
;  ;
;
(2)S的非金属性强于C,故得电子能力比C强,故答案为:弱于;
(3)原子序数比R多8的元素为P,由于NH3中存在氢键,故NH3的熔沸点高于PH3,故答案为:低;
(4)依据分析可知R为N,处于周期表中第二周期第ⅤA族,最高正价为+5价,最低负价为-3价,故是⑦,与Al同周期且最高价氧化物的水化物碱性最强的元素是Na,最高价为+1价,且在本周期中原子半径最大,故为:⑥,故答案为:⑦;⑥.
(1)W为S,S有3个电子层,最外层6个电子,故处于第三周期ⅥA族,电子层数越多,半径越大,同一周期原子序数越小,半径越大,故C、N、Al三种元素原子的半径从大到小排列顺序Al>C>N,C的最高价氧化物为二氧化碳,CO2中C与O形成两对共价键,故电子式为
 ,R为N,N的气态氢化物为NH3,NH3的结构式为
,R为N,N的气态氢化物为NH3,NH3的结构式为 ,故答案为:第三周期ⅥA族; Al>C>N;
,故答案为:第三周期ⅥA族; Al>C>N;  ;
;  ;
;(2)S的非金属性强于C,故得电子能力比C强,故答案为:弱于;
(3)原子序数比R多8的元素为P,由于NH3中存在氢键,故NH3的熔沸点高于PH3,故答案为:低;
(4)依据分析可知R为N,处于周期表中第二周期第ⅤA族,最高正价为+5价,最低负价为-3价,故是⑦,与Al同周期且最高价氧化物的水化物碱性最强的元素是Na,最高价为+1价,且在本周期中原子半径最大,故为:⑥,故答案为:⑦;⑥.
点评:本题考查学生元素周期表和元素周期律知识,可以根据所学知识进行回答,难度不大.

练习册系列答案
相关题目
金属晶体的堆积方式、空间利用率和配位数关系正确的是( )
| A、钋Po--简单立方堆积--52%--6 |
| B、钠Na--钾型--74%--12 |
| C、锌Zn--镁型--68%--8 |
| D、银Ag--铜型--74%--8 |
下列说法中,正确的是( )
| A、冰融化是化学变化 |
| B、电解饱和食盐水是物理变化 |
| C、碘升华是物理变化 |
| D、原子是最小的微粒,不可再分通电 |
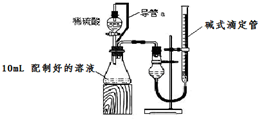 实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数w(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液.
实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数w(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液.