题目内容
短周期元素A、B、C、D、E的原子序数依次增大,A元素阳离子的原子核外没有电子,B是空气中含量最多的元素;C元素原子最外层电子数是其电子层数的三倍;C与D可形成两种常见的离子化合物;工业上常用电解E的氧化物来制备E单质.
(1)画出D元素的原子结构示意图 .C、D、E的原子半径由小到大的顺序 (用元素符号表示).
(2)写出元素E在周期表中的位置 .
(3)由元素A、B、C按原子个数比4:2:3形成的化合物含有的化学键的类型是 ,写出其电离方程式: .
(4)工业上常用A和B的单质合成一种碱性气体,该气体的结构式式 .
(5)写出D2C2的电子式 ;写出D2C2与H2O反应的化学方程式是 ,D2C2与CuSO4溶液反应的现象是 .
(1)画出D元素的原子结构示意图
(2)写出元素E在周期表中的位置
(3)由元素A、B、C按原子个数比4:2:3形成的化合物含有的化学键的类型是
(4)工业上常用A和B的单质合成一种碱性气体,该气体的结构式式
(5)写出D2C2的电子式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:短周期元素A、B、C、D、E的原子序数依次增大,A元素阳离子的原子核外没有电子,则A为氢元素;B是空气中含量最多的元素,B为氮元素;C元素原子最外层电子数是其电子层数的三倍,C只能处于第二周期,最外层电子数为6,故C为氧元素,且C与D可形成两种常见的离子化合物,故D为Na元素;工业上常用电解E的氧化物来制备E单质,E为Al元素,据此解答.
解答:
解:短周期元素A、B、C、D、E的原子序数依次增大,A元素阳离子的原子核外没有电子,则A为氢元素;B是空气中含量最多的元素,B为氮元素;C元素原子最外层电子数是其电子层数的三倍,C只能处于第二周期,最外层电子数为6,故C为氧元素,且C与D可形成两种常见的离子化合物,故D为Na元素;工业上常用电解C与E的化合物来制备E单质,E为Al元素,
(1)Na原子核外电子数为11,有3个电子层,各层电子数为2、8、1,原子结构示意图为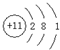 ,电子层数越多,原子半径越大,电子层数相同核电荷数越大原子半径越小,故C、D、E的原子半径由小到大的顺序为O<Al<Na,故答案为:
,电子层数越多,原子半径越大,电子层数相同核电荷数越大原子半径越小,故C、D、E的原子半径由小到大的顺序为O<Al<Na,故答案为: ;O<Al<Na;
;O<Al<Na;
(2)E为Al元素,处于周期表中第三周期ⅢA族,故答案为:第三周期ⅢA族;
(3)由H、N、O按原子个数比4:2:3形成的化合物为NH4NO3,在铵根离子和硝酸根离子内部都有共价键,在铵根离子和硝酸根离子之间为离子键,其电离方程式为:NH4NO3=NH4++NO3-,故答案为:离子键、共价键;NH4NO3=NH4++NO3-.
(4)工业上常用氢气和氮气合成氨气,氨气的结构式为 ,故答案为:
,故答案为: ;
;
(5)D2C2为Na2O2,它与H2O反应生成NaOH与O2,化学方程式是2Na2O2+2H2O=4NaOH+O2↑,Na2O2与CuSO4溶液反应,首先与H2O反应生成NaOH与O2,然后NaOH与CuSO4溶液反应生成Cu(OH)2,故现象是:产生无色无味气体,生成蓝色絮状沉淀,
故答案为: ;2Na2O2+2H2O=4NaOH+O2↑;产生无色无味气体,生成蓝色絮状沉淀.
;2Na2O2+2H2O=4NaOH+O2↑;产生无色无味气体,生成蓝色絮状沉淀.
(1)Na原子核外电子数为11,有3个电子层,各层电子数为2、8、1,原子结构示意图为
 ,电子层数越多,原子半径越大,电子层数相同核电荷数越大原子半径越小,故C、D、E的原子半径由小到大的顺序为O<Al<Na,故答案为:
,电子层数越多,原子半径越大,电子层数相同核电荷数越大原子半径越小,故C、D、E的原子半径由小到大的顺序为O<Al<Na,故答案为: ;O<Al<Na;
;O<Al<Na;(2)E为Al元素,处于周期表中第三周期ⅢA族,故答案为:第三周期ⅢA族;
(3)由H、N、O按原子个数比4:2:3形成的化合物为NH4NO3,在铵根离子和硝酸根离子内部都有共价键,在铵根离子和硝酸根离子之间为离子键,其电离方程式为:NH4NO3=NH4++NO3-,故答案为:离子键、共价键;NH4NO3=NH4++NO3-.
(4)工业上常用氢气和氮气合成氨气,氨气的结构式为
 ,故答案为:
,故答案为: ;
;(5)D2C2为Na2O2,它与H2O反应生成NaOH与O2,化学方程式是2Na2O2+2H2O=4NaOH+O2↑,Na2O2与CuSO4溶液反应,首先与H2O反应生成NaOH与O2,然后NaOH与CuSO4溶液反应生成Cu(OH)2,故现象是:产生无色无味气体,生成蓝色絮状沉淀,
故答案为:
 ;2Na2O2+2H2O=4NaOH+O2↑;产生无色无味气体,生成蓝色絮状沉淀.
;2Na2O2+2H2O=4NaOH+O2↑;产生无色无味气体,生成蓝色絮状沉淀.
点评:本题考查结构性质位置关系,推断元素是解题关键,涉及电子式、元素周期表、原子半径比较、元素化合物性质、常用化学用语等,题目难度中等.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
下列说法不正确的是( )
| A、乙醇的沸点低于丁醇;正丁烷的沸点高于异丁烷;并且丁醇的沸点高于丁烷 |
| B、用甘氨酸H2NCH(CH3)CHCOOH和H2NCH(CH3)COOH缩合最多可形成4种二肽 |
| C、乙醛、柠檬酸、甲酸、乙酸甲酯、葡萄糖、麦芽糖都能发生银镜反应 |
| D、C4H8属于烯烃类的同分异构体中存在顺反异构的只有一种 |
下列叙述正确的是( )
| A、液态氯化氢、固体氯化钾均不导电,故HCl和KCl均为非电解质 |
| B、SO2、SO3水溶液都能导电,故二者均为电解质 |
| C、铜和石墨均能导电,所以它们都是电解质 |
| D、蔗糖、乙醇在水溶液中和熔融状态下都不导电,所以它们是非电解质 |
美国UIC大学两位国家级传染病学专家认为,当前形势的埃博拉病毒已经能够通过气溶胶传播.据此,下列说法正确的是( )
| A、埃博拉病毒无法通过呼吸传播 |
| B、佩戴口罩可有效预防埃博拉病毒侵染 |
| C、目前已找到有效治疗埃博拉病毒的方法 |
| D、埃博拉病毒颗粒直径大约80nm |
下列化学用语正确的是( )
A、乙酸根离子的结构式: |
| B、3-甲基1-丁烯的结构简式:(CH3)2CHCH═CH2 |
| C、乙酸的结构简式C2H4O2 |
D、醛基的电子式: |
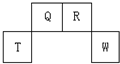 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题: