题目内容
同温同压下,下列各组热化学方程式中,△H1<△H2是( )
A、C(s)+
| ||||
B、
| ||||
| C、2H2(g)+O2(g)=2H2O(g);△H12H2(g)+O2(g)=2H2O(l);△H2 | ||||
| D、S(g)+O2(g)=SO2(g);△H1 S(s)+O2(g)=SO2(g);△H2 |
考点:反应热的大小比较
专题:
分析:A、碳单质完全燃烧放热多于不完全燃烧放的热;
B、化学反应方程式的系数加倍,焓变数值加倍;
C、液态水变为气态水的过程是吸热过程;
D、固体硫变为气态硫需要吸收热量;
B、化学反应方程式的系数加倍,焓变数值加倍;
C、液态水变为气态水的过程是吸热过程;
D、固体硫变为气态硫需要吸收热量;
解答:
解:A、碳单质完全燃烧生成二氧化碳放热多于不完全燃烧生成一氧化碳放的热,反应的焓变是负值,故△H1>△H2,故A错误;
B、化学反应方程式的系数加倍,焓变数值加倍,该化合反应是放热的,所以焓变值是负值,△H1=2△H2,△H1>△H2,故B错误;
C、物质的燃烧反应是放热的,焓变是负值,液态水变为气态水的过程是吸热的,故△H1>△H2,故C错误;
D、物质的燃烧反应是放热的,所以焓变是负值,固体硫变为气态硫需要吸收热量,所以△H1<△H2,故D正确;
故选:D.
B、化学反应方程式的系数加倍,焓变数值加倍,该化合反应是放热的,所以焓变值是负值,△H1=2△H2,△H1>△H2,故B错误;
C、物质的燃烧反应是放热的,焓变是负值,液态水变为气态水的过程是吸热的,故△H1>△H2,故C错误;
D、物质的燃烧反应是放热的,所以焓变是负值,固体硫变为气态硫需要吸收热量,所以△H1<△H2,故D正确;
故选:D.
点评:本题考查了物质反应能量变化分析判断,主要是盖斯定律的应用,物质量不同、状态不同、产物不同,反应的能量变化本题,题目较简单.

练习册系列答案
 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案
相关题目
已知2Zn(s)+O2(g)=2ZnO(s)△H=-700kJ/mol,则1g Zn在氧气中燃烧放出的热量约为( )
| A、5.4 kJ |
| B、350 kJ |
| C、3.5 kJ |
| D、8.5 kJ |
下列表示对应化学反应的离子方程式正确的是( )
| A、将过量SO2通入冷氨水中:SO2+NH3?H2O═HSO3-+NH4+ | ||||
B、向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-
| ||||
| C、用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- | ||||
| D、用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-═Ag++NO↑+H2O |
下列实验描述,符合事实的是( )
| A、金属钠暴露在空气中,表面变暗,生成淡黄色固体氧化钠 |
| B、用坩埚钳夹住打磨过的镁带,在酒精灯上点燃,发出耀眼白光,放出大量的热,产生白色固体 |
| C、用坩埚钳夹住铝箔在酒精灯上点燃,发出耀眼的白光,放出大量的热 |
| D、用坩埚钳夹住铝箔在酒精灯上加热至熔化,轻轻晃动,有液态的铝滴落下来 |
设NA为阿伏加德罗常数,下列说法正确的是( )
| A、1L 0.1mol/L的Na2CO3溶液中,含Na+0.2 NA个,CO32-0.1 NA个 |
| B、1L 0.3mol/L的K2SO4溶液中,含K+和SO42-离子总数为0.9 NA个 |
| C、2L 0.6mol/L的Fe2(SO4)3溶液中,含SO42-离子总数为2.4 NA个 |
| D、0.1mol/L的H3PO4溶液中,c(H+):c(PO43-)<3:1 |
下列有关叙述正确的是( )
| A、氢键是一种特殊化学键,它广泛地存在于自然界中 |
| B、在CH3-CH-COOH分子中含有1个手性C原子 |
| C、碘单质在水溶液中溶解度很小是因为I2和H2O都是非极性分子 |
| D、含氧酸可用通式XOm(OH)n表示,若n值越大,则含氧酸的酸性越大 |
下列关于2mol氧气的叙述中,正确的是( )
| A、质量是32g |
| B、体积是44.8L |
| C、分子数是2×6.02×1023 |
| D、电子数是32 |
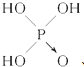 )中三个氢原子都可以跟重水(D2O)中氘原子发生交换,又知次磷酸(H3PO2)也能跟D2O进行氢交换,次磷酸钠(NaH2PO2)却不能再跟D2O发生氢交换,由此推断出次磷酸分子的结构是( )
)中三个氢原子都可以跟重水(D2O)中氘原子发生交换,又知次磷酸(H3PO2)也能跟D2O进行氢交换,次磷酸钠(NaH2PO2)却不能再跟D2O发生氢交换,由此推断出次磷酸分子的结构是( )