题目内容
下列有关叙述正确的是( )
| A、氢键是一种特殊化学键,它广泛地存在于自然界中 |
| B、在CH3-CH-COOH分子中含有1个手性C原子 |
| C、碘单质在水溶液中溶解度很小是因为I2和H2O都是非极性分子 |
| D、含氧酸可用通式XOm(OH)n表示,若n值越大,则含氧酸的酸性越大 |
考点:含有氢键的物质,“手性分子”在生命科学等方面的应用,相似相溶原理及其应用
专题:
分析:A.氢键是一种分子间作用力,不是化学键;
B.一个碳原子与其它四个不同的原子或原子团相连的碳为手性C原子;
C.I2和是非极性分子而H2O是极性分子,非极性分子难溶于极性溶剂;
D.含氧酸可用通式XOm(OH)n来表示,式中m大于等于2的是强酸,m为0的是弱酸,据此可知,非羟基氧原子数目越大,酸性越强.
B.一个碳原子与其它四个不同的原子或原子团相连的碳为手性C原子;
C.I2和是非极性分子而H2O是极性分子,非极性分子难溶于极性溶剂;
D.含氧酸可用通式XOm(OH)n来表示,式中m大于等于2的是强酸,m为0的是弱酸,据此可知,非羟基氧原子数目越大,酸性越强.
解答:
解:A、氢键是一种分子间作用力,不是化学键,故A错误;
B.一个碳原子与其它四个不同的原子或原子团相连的碳为手性C原子,中间的碳为手性C原子,故B正确;
C.I2和是非极性分子而H2O是极性分子,非极性分子难溶于极性溶剂,相似相溶的所以碘单质在水溶液中溶解度很小,故C错误;
D.含氧酸可用通式XOm(OH)n来表示,式中m大于等于2的是强酸,m为0的是弱酸,据此可知,非羟基氧原子数目越大,酸性越强,故D错误;
故选B.
B.一个碳原子与其它四个不同的原子或原子团相连的碳为手性C原子,中间的碳为手性C原子,故B正确;
C.I2和是非极性分子而H2O是极性分子,非极性分子难溶于极性溶剂,相似相溶的所以碘单质在水溶液中溶解度很小,故C错误;
D.含氧酸可用通式XOm(OH)n来表示,式中m大于等于2的是强酸,m为0的是弱酸,据此可知,非羟基氧原子数目越大,酸性越强,故D错误;
故选B.
点评:本题考查分子间作用力和分子的极性、手性C原子,根据非羟基氧原子数目多少来确定酸性强弱即可,难度不大.

练习册系列答案
相关题目
有下列四种有机物,其苯环上的一氯代物的数目之比分别( )


| A、2:3:1:3 |
| B、4:5:4:4 |
| C、2:3:2:4 |
| D、1:3:1:2 |
下列叙述正确的是( )
| A、天然油脂的分子中含有酯基,属于酯类 |
| B、苯的分子式为C6H6,分子中的碳原子远远没有饱和,因此能和氯水发生加成反应 |
| C、所有卤代烃都难溶于水,且都是密度比水大的液体 |
| D、天然气与液化石油气的成分相同,与水煤气的成分不相同 |
同温同压下,下列各组热化学方程式中,△H1<△H2是( )
A、C(s)+
| ||||
B、
| ||||
| C、2H2(g)+O2(g)=2H2O(g);△H12H2(g)+O2(g)=2H2O(l);△H2 | ||||
| D、S(g)+O2(g)=SO2(g);△H1 S(s)+O2(g)=SO2(g);△H2 |
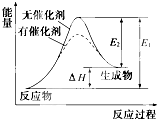 某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )| A、催化剂能改变该反应的焓变 |
| B、催化剂能降低该反应的活化能 |
| C、该反应为放热反应 |
| D、逆反应的活化能大于正反应的活化能 |
FeCl3溶液和Fe(OH)3胶体的共同性质是( )
| A、都能产生丁达尔效应现象 |
| B、都能透过半透膜 |
| C、通常情况下均稳定透明 |
| D、分散质粒子直径都是1~100nm |
下列反应的离子方程式正确的是 ( )
| A、向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O═Fe(OH)3↓+3H+ |
| B、用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O |
| C、将氯气通入NaOH溶液中制取84消毒液:2Cl2+2OH-=ClO-+3Cl-+H2O |
| D、向Na2O2固体中滴加水:Na2O2+H2O=2Na++2OH-+O2↑ |
我们将100g食品烧成灰分的水溶液用0.1mol/L的酸或碱进行中和,所需酸或碱的体积(单位:mL)定为该食品的碱度或酸度,现已知豆腐的碱度为2.00,则中和100g豆腐所消耗的酸的物质的量是( )
| A、0.2mol |
| B、0.0002mol |
| C、0.05mo l |
| D、5 mol |