题目内容
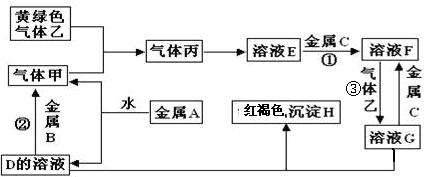
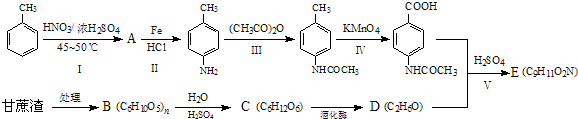
用以下三种途径来制取相同质量的硝酸铜:①铜与浓硝酸反应;②铜与稀硝酸反应;③铜与氧气反应生成CuO,CuO再与稀硝酸反应.下列有关叙述不正确的是( )
| A、所消耗的硝酸的量:①>②>③ |
| B、对环境造成的危害,③最小 |
| C、因铜与浓硝酸作用最快,故制取硝酸铜的最佳方案是① |
| D、三种途径所消耗的铜的质量不相等 |
考点:硝酸的化学性质
专题:氮族元素
分析:A.反应方程式分别为①Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O ②3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O、③2Cu+O2=2CuO、CuO+2HNO3=Cu(NO3)2+H2O,根据方程式判断;
B.NO、NO2都是有毒气体,污染大气;
C.制取硝酸铜时不仅考虑反应速率还要考虑环保、反应物的用量;
D.根据原子守恒判断.
B.NO、NO2都是有毒气体,污染大气;
C.制取硝酸铜时不仅考虑反应速率还要考虑环保、反应物的用量;
D.根据原子守恒判断.
解答:
解:A.反应方程式分别为①Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O ②3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O、③2Cu+O2=2CuO、CuO+2HNO3=Cu(NO3)2+H2O,根据方程式知,制取相同的硝酸铜需要硝酸的物质的量之比为12:8:6=6:4:3,所以消耗硝酸的量:①>②>③,故A正确;
B.NO、NO2都是有毒气体,污染大气,根据方程式知,只有③中不产生有毒气体,所以③对环境造成的危害最小,故B正确;
C.①②中都产生有毒气体,不环保,且③中使用硝酸的量最少,所以制取硝酸铜的最佳方案是③,故C错误;
D.根据铜原子守恒知,制取相同的硝酸铜时需要Cu的量相等,故D错误;
故选CD.
B.NO、NO2都是有毒气体,污染大气,根据方程式知,只有③中不产生有毒气体,所以③对环境造成的危害最小,故B正确;
C.①②中都产生有毒气体,不环保,且③中使用硝酸的量最少,所以制取硝酸铜的最佳方案是③,故C错误;
D.根据铜原子守恒知,制取相同的硝酸铜时需要Cu的量相等,故D错误;
故选CD.
点评:本题以硝酸铜的制取为载体考查了硝酸的性质,根据方程式中的硝酸的物质的量、生成物的性质结合原子守恒来分析解答,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
一定温度下可逆反应:A(s)+2B(g)?2C(g)+D(g)△H<0.现将1mol A和2mol B加入甲容器中,将4mol C和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动).下列说法正确的是( )


| A、保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增大 |
| B、保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 |
| C、保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
| D、保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 |
在4NH4+5O2?4NO+6H2O反应中,表示该反应速率最快的是( )
| A、υ(NH4)=0.8 mol/(L?s) |
| B、υ(O2)=1.0 mol/(L?s) |
| C、υ(NO)=1.0 mol/(L?s) |
| D、υ(H2O)=1.8 mol/(L?s) |
下列说法正确的是( )
| A、HClO是强酸 |
| B、根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液 |
| C、Fe在足量Cl2中燃烧只生成FeCl3 |
| D、二氧化硅是将太阳能转化为电能的常用材料 |