题目内容
如图1所示,某兴趣小组同学将铜片加入稀硝酸,发现开始时气泡产生速率非常慢,一段时间后速率明显加快,烧瓶内溶液呈浅蓝色并不断加深,液面上方的气体颜色也在不断加深.该小组同学拟通过实验探究反应速率变化的原因.
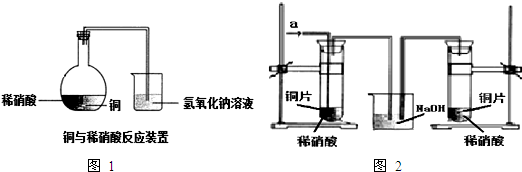
(1)图1中铜与稀硝酸反应的离子方程式为 ;
用离子方程式表示NaOH溶液所起的作用 ;
(2)小组同学提出了如下假设并设计实验探究:
Ⅰ.甲同学认为是反应放热导致溶液温度升高所致,完成此实验还需要的仪器是 ;
测定反应过程中溶液不同时间的温度,结果如表:
结合实验目的和表中数据,你得出的结论是 ;
Ⅱ.乙同学认为生成的Cu2+对反应有催化作用,为验证此假设,取A、B两支试管分别加入等量的铜片和稀硝酸,那么最好是在其中一支试管中加入少量的 (填序号),
A.硝酸铜晶体 B.硝酸铜溶液 C.硫酸铜晶体 D.硫酸铜溶液
然后对比两支试管的反应,发现现象基本相同.因此得出结论:Cu2+并不是反应的催化剂.
Ⅲ.丙同学根据现象推测反应过程中还有少量 生成,进而认为该物质对反应有催化作用,如图2所示,实验中丙同学从a处通入该物质后,发现左管中产生气泡速率明显快于右管.小组同学得出最后结论:这种物质对铜和稀硝酸的反应有催化作用.
(3)实验结束后,发现试管中溶液呈绿色,而不显蓝色.部分同学认为是该溶液中硝酸铜的质量分数较高所致,另一部分同学认为是该溶液中溶解了通入的物质.请你设计一个实验方案来证明哪种假设正确.(写出实验操作、实验现象和结论)
.

(1)图1中铜与稀硝酸反应的离子方程式为
用离子方程式表示NaOH溶液所起的作用
(2)小组同学提出了如下假设并设计实验探究:
Ⅰ.甲同学认为是反应放热导致溶液温度升高所致,完成此实验还需要的仪器是
测定反应过程中溶液不同时间的温度,结果如表:
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 35 | 50 | 60 | 70 | 80 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26 | 26 | 26.5 | 27 | 27 | 27 | 27 |
Ⅱ.乙同学认为生成的Cu2+对反应有催化作用,为验证此假设,取A、B两支试管分别加入等量的铜片和稀硝酸,那么最好是在其中一支试管中加入少量的
A.硝酸铜晶体 B.硝酸铜溶液 C.硫酸铜晶体 D.硫酸铜溶液
然后对比两支试管的反应,发现现象基本相同.因此得出结论:Cu2+并不是反应的催化剂.
Ⅲ.丙同学根据现象推测反应过程中还有少量
(3)实验结束后,发现试管中溶液呈绿色,而不显蓝色.部分同学认为是该溶液中硝酸铜的质量分数较高所致,另一部分同学认为是该溶液中溶解了通入的物质.请你设计一个实验方案来证明哪种假设正确.(写出实验操作、实验现象和结论)
考点:探究影响化学反应速率的因素
专题:实验探究和数据处理题
分析:(1)铜和稀硝酸反应生成硝酸铜、一氧化氮和水;NaOH溶液可以吸收二氧化氮和一氧化氮气体;
(2)Ⅰ、测量温度变化的常用仪器为温度计;验证温度对速率的影响,获得实验数据后可以获得一系列结论,如果把它放在整个实验探究中去理解可知最重要的结论是反应液温度上升不是反应速率明显加快的主要原因;
Ⅱ、加入固体,不能加入溶液,否则溶液浓度减小,不能加入硫酸根离子;
Ⅲ、液面上方的气体颜色不断加深,说明生成了NO2气体;
(3)根据改变溶液中硝酸铜的质量分数或溶解气体的浓度是否影响溶液的颜色来判断.
(2)Ⅰ、测量温度变化的常用仪器为温度计;验证温度对速率的影响,获得实验数据后可以获得一系列结论,如果把它放在整个实验探究中去理解可知最重要的结论是反应液温度上升不是反应速率明显加快的主要原因;
Ⅱ、加入固体,不能加入溶液,否则溶液浓度减小,不能加入硫酸根离子;
Ⅲ、液面上方的气体颜色不断加深,说明生成了NO2气体;
(3)根据改变溶液中硝酸铜的质量分数或溶解气体的浓度是否影响溶液的颜色来判断.
解答:
解:(1)铜和稀硝酸反应生成硝酸铜、一氧化氮和水,反应的离子方程式为:3Cu+8H++2NO3-(稀)═3Cu2++2NO?+4H2O;NaOH溶液可以吸收二氧化氮和一氧化氮气体,反应的离子方程式为:NO+NO2+2OH-═2NO2-+H2O,
故答案为:3Cu+8H++2NO3-(稀)═3Cu2++2NO?+4H2O;NO+NO2+2OH-═2NO2-+H2O;
(2)Ⅰ、测量温度变化的常用仪器为温度计;由表中数据可知,随着反应的进行,反应速率明显加快,但温度变化不大,所以温度不是反应速率明显加快的主要原因;
故答案为:温度计;温度不是反应速率明显加快的主要原因;
Ⅱ、加入固体,不能加入溶液,否则溶液浓度减小,不能加入硫酸根离子,故选A;
Ⅲ、液面上方的气体颜色不断加深,说明生成了NO2气体,故答案为:NO2;
(3)要证明是Cu(NO3)2浓度过低或是溶解了NO2导致装置中溶液呈绿色,一是可设计将溶解的NO2赶走再观察颜色变化.二是增加溶液中Cu(NO3)2溶液的浓度观察反应后的颜色变化,故答案为:加热该绿色溶液,观察颜色变化(或向该绿色溶液中通入氮气,观察颜色变化或向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化).
故答案为:3Cu+8H++2NO3-(稀)═3Cu2++2NO?+4H2O;NO+NO2+2OH-═2NO2-+H2O;
(2)Ⅰ、测量温度变化的常用仪器为温度计;由表中数据可知,随着反应的进行,反应速率明显加快,但温度变化不大,所以温度不是反应速率明显加快的主要原因;
故答案为:温度计;温度不是反应速率明显加快的主要原因;
Ⅱ、加入固体,不能加入溶液,否则溶液浓度减小,不能加入硫酸根离子,故选A;
Ⅲ、液面上方的气体颜色不断加深,说明生成了NO2气体,故答案为:NO2;
(3)要证明是Cu(NO3)2浓度过低或是溶解了NO2导致装置中溶液呈绿色,一是可设计将溶解的NO2赶走再观察颜色变化.二是增加溶液中Cu(NO3)2溶液的浓度观察反应后的颜色变化,故答案为:加热该绿色溶液,观察颜色变化(或向该绿色溶液中通入氮气,观察颜色变化或向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化).
点评:本题考查了铜和硝酸的反应实验,难点是(3)题,会设计实验验证是Cu(NO3)2浓度过低或是溶解了NO2导致装置中溶液呈绿色,设计实验是高考的热点,也是学习的难点.

练习册系列答案
相关题目
下列关于水在人体中的作用错误的是( )
| A、提供能量 |
| B、做营养物质水解的反应物 |
| C、做溶剂 |
| D、调节体温 |
除去括号内杂质所用试剂和方法不正确的是( )
| A、植物油(水)--分液 |
| B、Fe(OH)3胶体(HCl)--渗析 |
| C、水(NaCl)--蒸馏 |
| D、CO2(HCl)--氢氧化钠溶液,洗气 |
关于下列有机化合物的说法正确的是( )
| A、溴乙烷和乙烷都是饱和烃 |
| B、甲烷和乙烯都可以与氯气反应 |
| C、高锰酸钾可以氧化苯和甲烷 |
| D、乙烯可以与氢气发生加成反应,苯不能与氢气加成 |
 KOH是一种重要的化工原料,广泛应用于K2CO3的生产.某研究性学习小组设计了两套实验方案进行实验:
KOH是一种重要的化工原料,广泛应用于K2CO3的生产.某研究性学习小组设计了两套实验方案进行实验: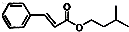 )的路线如下:
)的路线如下: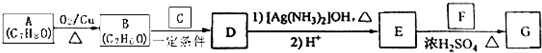
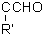 +H2O.
+H2O.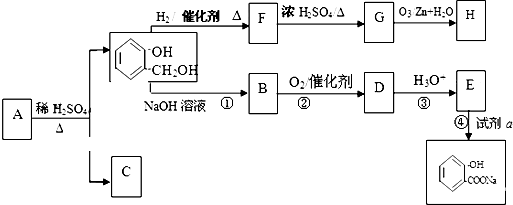
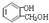 与饱和溴水反应的化学方程式
与饱和溴水反应的化学方程式 反应是否进行完全,设计一个简单实验加以证明并写出实验操作、现象及结论为
反应是否进行完全,设计一个简单实验加以证明并写出实验操作、现象及结论为