题目内容
 KOH是一种重要的化工原料,广泛应用于K2CO3的生产.某研究性学习小组设计了两套实验方案进行实验:
KOH是一种重要的化工原料,广泛应用于K2CO3的生产.某研究性学习小组设计了两套实验方案进行实验:【方案甲】
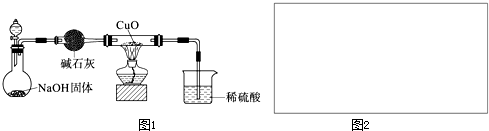
实验步骤:量取240mL 2mol/L KOH溶液,向其中通入过量CO2,充分反应后,蒸
发、结晶、灼烧制得K2CO3固体.
问题讨论:(1)配制以上KOH溶液时,需称取KOH固体
(2)蒸发结晶过程中用玻璃棒搅拌的目的是
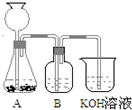
(3)用CaCO3和稀盐酸制取并将CO2通入KOH溶液的实验装置如图所示.装置B中盛放的试剂是
【方案乙】
实验步骤:操作①:将240mL KOH溶液等分于两烧杯中;
操作②:向其中一只烧杯中
操作③:将②中所得溶液用小火煮沸1~2min;
操作④:将③中所得溶液和另一烧杯中的溶液混合,使其充分反应;
操作⑤:蒸发、结晶制得K2CO3固体.
问题讨论:(4)用小火煮沸溶液1~2min的目的是
(5)从原子经济性角度分析,方案
考点:性质实验方案的设计
专题:实验设计题
分析:【方案甲】(1)根据m=nM=cVM来计算质量;
(2)蒸发结晶过程中用玻璃棒搅拌可以加快蒸发速度并防止液体局部过热,发生飞溅;
(3)用CaCO3和稀盐酸制取的CO2中含有HCl杂质,可以用饱和碳酸氢钠来除去;
【方案乙】过量二氧化碳可以和氢氧化钾之间反应生成碳酸钾,碳酸氢钾可以和氢氧化钾之间反应生成碳酸钾和水;
问题讨论:(4)将水溶液煮沸可以驱赶溶液中的气泡,据此回答;
(5)方案甲:氢氧化钾可以和过量的二氧化碳反应生成碳酸氢钾,碳酸氢钾受热分解为碳酸钾;
方案乙:过量二氧化碳可以和氢氧化钾之间反应生成碳酸钾,碳酸氢钾可以和氢氧化钾之间反应生成碳酸钾和水,对比两个方案,得出答案.
(2)蒸发结晶过程中用玻璃棒搅拌可以加快蒸发速度并防止液体局部过热,发生飞溅;
(3)用CaCO3和稀盐酸制取的CO2中含有HCl杂质,可以用饱和碳酸氢钠来除去;
【方案乙】过量二氧化碳可以和氢氧化钾之间反应生成碳酸钾,碳酸氢钾可以和氢氧化钾之间反应生成碳酸钾和水;
问题讨论:(4)将水溶液煮沸可以驱赶溶液中的气泡,据此回答;
(5)方案甲:氢氧化钾可以和过量的二氧化碳反应生成碳酸氢钾,碳酸氢钾受热分解为碳酸钾;
方案乙:过量二氧化碳可以和氢氧化钾之间反应生成碳酸钾,碳酸氢钾可以和氢氧化钾之间反应生成碳酸钾和水,对比两个方案,得出答案.
解答:
解:【方案甲】(1)配制240mL2mol/LKOH溶液需要250mL的容量瓶,需要固体质量m=0.25L×2mol/L×56g/mol=28.0g,故答案为:28.0;
(2)蒸发结晶过程中用玻璃棒搅拌可以加快蒸发速度并防止液体局部过热,发生飞溅,故答案为:加快蒸发速度并防止液体局部过热,发生飞溅;
(3)用CaCO3和稀盐酸制取的CO2中含有HCl杂质,可以用饱和碳酸氢钠来除去,故答案为:饱和碳酸氢钠溶液;吸收二氧化碳中的HCl气体;
【方案乙】过量二氧化碳可以和氢氧化钾之间反应生成碳酸钾,CO2+KOH=KHCO3碳酸氢钾可以和氢氧化钾之间反应生成碳酸钾和水,KOH+KHCO3=K2CO3+H2O,
故答案为:通入过量的二氧化碳至不再溶解;CO2+KOH=KHCO3;
问题讨论:(4)用小火煮沸溶液1~2min的目的是驱赶溶液中的气泡,故答案为:赶走溶液中的二氧化碳气体;
(5)方案甲:氢氧化钾可以和过量的二氧化碳反应生成碳酸氢钾,碳酸氢钾受热分解为碳酸钾;
方案乙:过量二氧化碳可以和氢氧化钾之间反应生成碳酸钾,碳酸氢钾可以和氢氧化钾之间反应生成碳酸钾和水,对比两个方案发现:得到等量K2CO3固体时,方案甲比方案乙CO2的消耗量高,即方案乙中的原子利用率高,
故答案为:乙;方案乙中的原子利用率高(或得到等量K2CO3固体时,方案甲比方案乙CO2的消耗量高).
(2)蒸发结晶过程中用玻璃棒搅拌可以加快蒸发速度并防止液体局部过热,发生飞溅,故答案为:加快蒸发速度并防止液体局部过热,发生飞溅;
(3)用CaCO3和稀盐酸制取的CO2中含有HCl杂质,可以用饱和碳酸氢钠来除去,故答案为:饱和碳酸氢钠溶液;吸收二氧化碳中的HCl气体;
【方案乙】过量二氧化碳可以和氢氧化钾之间反应生成碳酸钾,CO2+KOH=KHCO3碳酸氢钾可以和氢氧化钾之间反应生成碳酸钾和水,KOH+KHCO3=K2CO3+H2O,
故答案为:通入过量的二氧化碳至不再溶解;CO2+KOH=KHCO3;
问题讨论:(4)用小火煮沸溶液1~2min的目的是驱赶溶液中的气泡,故答案为:赶走溶液中的二氧化碳气体;
(5)方案甲:氢氧化钾可以和过量的二氧化碳反应生成碳酸氢钾,碳酸氢钾受热分解为碳酸钾;
方案乙:过量二氧化碳可以和氢氧化钾之间反应生成碳酸钾,碳酸氢钾可以和氢氧化钾之间反应生成碳酸钾和水,对比两个方案发现:得到等量K2CO3固体时,方案甲比方案乙CO2的消耗量高,即方案乙中的原子利用率高,
故答案为:乙;方案乙中的原子利用率高(或得到等量K2CO3固体时,方案甲比方案乙CO2的消耗量高).
点评:本题是一道物质的制备的实验方案设计题,考查学生分析和解决问题的能力,综合性强,难度大.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
将0.2mol?L-1Ba(OH)2溶液与0.05mol?L-1NaHSO4溶液等体积混合后,下列几种离子浓度大小顺序正确的是( )
| A、c(Ba2+)>c(OH-)>c(Na+)>c(SO42-) |
| B、c(Na+)>c(OH-)>c(Ba2+)>c(SO42-) |
| C、c(Na+)>c(Ba2+)>c(OH-)>c(SO42-) |
| D、c(OH-)>c(Ba2+)>c(Na+)>c(SO42-) |
用质量均为100g的Cu作电极,电解AgNO3溶液.稍电解一段时间后,两电极的质量相差28g,此时两电极的质量分别为( )
| A、阳极100 g,阴极128 g |
| B、阳极93.6 g,阴极121.6 g |
| C、阳极91.0 g,阴极119.0 g |
| D、阳极86.0 g,阴极114.0 g |
为减少新鲜蔬菜中的维生素C的流失,下列有关烹调蔬菜的方法不妥当的是( )
| A、蔬菜最好洗干净后再切 |
| B、炒蔬菜的时间不能太长,炒熟即可 |
| C、新鲜蔬菜应放在冰箱中储存 |
| D、把蔬菜放在高压锅中焖煮 |