题目内容
某化学研究性学习小组讨论Fe3+溶液和SO32-溶液之间发生怎样的反应,提出了两种可能,写出预计反应的离子方程式:
一是发生氧化还原反应 ;二是发生互促水解反应 .
为了证明发生怎样的反应,同学们设计并进行如下实验,请填写下列空白:
实验Ⅰ:取5mLFeCl3浓溶液于试管中,逐滴加入某Na2SO3浓溶液至过量,观察到无气泡产生,无沉淀生成,但溶液颜色最终变为红褐色.这种红褐色液体是 .
向红褐色液体中逐滴加入稀盐酸至过量,可观察到溶液最终变为黄色.将所得溶液分成两等份:
其中一份加入KSCN溶液,溶液变成血红色,此步实验的目的是 ;另一份加入BaCl2稀溶液,有少量白色沉淀生成,产生该白色沉淀的离子方程式是 .
实验Ⅱ:将FeCl3和Na2SO3溶液分别稀释后,重复实验Ⅰ,产生的现象完全相同.同学们由上述实验得出的结论是 .
指导老师看过上述实验步骤后认为该设计有缺陷,应在开始实验前对某主要药品进行检验,该主要药品为 ;检验的目的是 .
一是发生氧化还原反应
为了证明发生怎样的反应,同学们设计并进行如下实验,请填写下列空白:
实验Ⅰ:取5mLFeCl3浓溶液于试管中,逐滴加入某Na2SO3浓溶液至过量,观察到无气泡产生,无沉淀生成,但溶液颜色最终变为红褐色.这种红褐色液体是
向红褐色液体中逐滴加入稀盐酸至过量,可观察到溶液最终变为黄色.将所得溶液分成两等份:
其中一份加入KSCN溶液,溶液变成血红色,此步实验的目的是
实验Ⅱ:将FeCl3和Na2SO3溶液分别稀释后,重复实验Ⅰ,产生的现象完全相同.同学们由上述实验得出的结论是
指导老师看过上述实验步骤后认为该设计有缺陷,应在开始实验前对某主要药品进行检验,该主要药品为
考点:性质实验方案的设计
专题:实验设计题
分析:铁离子具有氧化性,亚硫酸根离子具有还原性,二者之间能发生氧化还原反应;铁离子水解显示酸性,亚硫酸根离子水解显示碱性,二者可以发生双水解反应;
实验Ⅰ:氢氧化铁胶体是红褐色的液体;硫氰酸钾可以检验铁离子的存在,亚硫酸钠很容易被氧化为硫酸钠,硫酸钠可以和氯化钡反应得到硫酸钡沉淀,据此回答;
实验Ⅱ:亚硫酸钠和氯化铁混合后能生成氢氧化铁,还能得到硫酸钡沉淀,说明铁离子和亚硫酸根之间即发生双水解反应还发生氧化还原反应,但是亚硫酸钠溶液极不稳定,很容易被氧气氧化为硫酸钠,所以实验之前应该检验亚硫酸钠是否变质,据此回答.
实验Ⅰ:氢氧化铁胶体是红褐色的液体;硫氰酸钾可以检验铁离子的存在,亚硫酸钠很容易被氧化为硫酸钠,硫酸钠可以和氯化钡反应得到硫酸钡沉淀,据此回答;
实验Ⅱ:亚硫酸钠和氯化铁混合后能生成氢氧化铁,还能得到硫酸钡沉淀,说明铁离子和亚硫酸根之间即发生双水解反应还发生氧化还原反应,但是亚硫酸钠溶液极不稳定,很容易被氧气氧化为硫酸钠,所以实验之前应该检验亚硫酸钠是否变质,据此回答.
解答:
解:铁离子具有氧化性,亚硫酸根离子具有还原性,Fe3+溶液和SO32-溶液之间发生氧化还原反应:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+,铁离子水解显示酸性,亚硫酸根离子水解显示碱性,二者可以发生双水解反应:2Fe3++3SO32-+6H2O=2Fe2++2Fe(OH)3↓+3H2SO4,
故答案为:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;2Fe3++3SO32-+6H2O=2Fe2++2Fe(OH)3↓+3H2SO4;
实验Ⅰ:FeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,铁离子能够与亚硫酸根离子发生水解生成了红褐色的氢氧化铁胶体;加入KSCN溶液,溶液变为血红色,反应反应的离子方程式为:Fe3++3SCN-═Fe(SCN)3,此步实验的目的是验证铁离子是否被还原,加入氯化钡生成白色沉淀,白色沉淀为硫酸钡,反应的离子方程式为:Ba2++SO42-═BaSO4,
故答案为:氢氧化铁胶体(或胶体);验证铁离子是否被还原;Ba2++SO42-═BaSO4↓;
实验Ⅱ:换用稀释的FeCl3和Na2SO3溶液重复实验Ⅱ,产生的现象完全相同,证明了Fe3+与SO32-发生氧化还原反应和双水解反应是同时进行的,但是亚硫酸钠溶液极不稳定,很容易被氧气氧化为硫酸钠,所以实验之前应该检验亚硫酸钠是否变质,即验证亚硫酸根离子是否已经被空气氧化,如果变质,则和铁离子的反应研究就失去意义,
故答案为:Fe3+与SO32-同时发生氧化还原反应和双水解反应;Na2SO3浓溶液;验证亚硫酸根离子是否已经被空气氧化.
故答案为:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;2Fe3++3SO32-+6H2O=2Fe2++2Fe(OH)3↓+3H2SO4;
实验Ⅰ:FeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,铁离子能够与亚硫酸根离子发生水解生成了红褐色的氢氧化铁胶体;加入KSCN溶液,溶液变为血红色,反应反应的离子方程式为:Fe3++3SCN-═Fe(SCN)3,此步实验的目的是验证铁离子是否被还原,加入氯化钡生成白色沉淀,白色沉淀为硫酸钡,反应的离子方程式为:Ba2++SO42-═BaSO4,
故答案为:氢氧化铁胶体(或胶体);验证铁离子是否被还原;Ba2++SO42-═BaSO4↓;
实验Ⅱ:换用稀释的FeCl3和Na2SO3溶液重复实验Ⅱ,产生的现象完全相同,证明了Fe3+与SO32-发生氧化还原反应和双水解反应是同时进行的,但是亚硫酸钠溶液极不稳定,很容易被氧气氧化为硫酸钠,所以实验之前应该检验亚硫酸钠是否变质,即验证亚硫酸根离子是否已经被空气氧化,如果变质,则和铁离子的反应研究就失去意义,
故答案为:Fe3+与SO32-同时发生氧化还原反应和双水解反应;Na2SO3浓溶液;验证亚硫酸根离子是否已经被空气氧化.
点评:本题考查了探究反应机理的方法,题目难度中等,是一道不错的题目,充分考查了学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
下列物质属于塑料的是( )
| A、聚乙烯 | B、锦纶 |
| C、阿胶 | D、玻璃钢 |
下列物质中,不能和氯气发生取代反应的是( )
| A、C8H18 |
| B、C2H5Cl |
| C、CH2Cl2 |
| D、CCl4 |
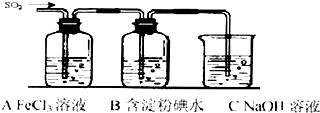
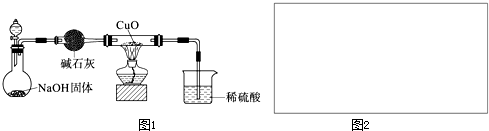

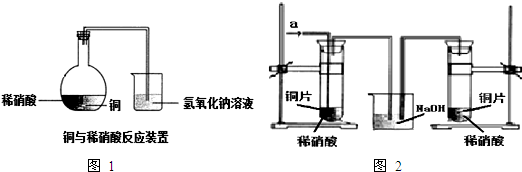


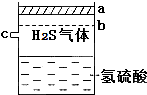 已知多元弱酸在水溶液中的电离是分步进行的,且第一步的电离程度大于第二步的电离程度,第二步的电离程度远大于第三步的电离程度…在密闭容器里盛有饱和H2S溶液和H2S气体,可上下移动的活塞停止在a处,如图所示.
已知多元弱酸在水溶液中的电离是分步进行的,且第一步的电离程度大于第二步的电离程度,第二步的电离程度远大于第三步的电离程度…在密闭容器里盛有饱和H2S溶液和H2S气体,可上下移动的活塞停止在a处,如图所示.