题目内容
已知有机物分子中的碳碳双键在一定条件下能被臭氧氧化,反应方程式为:RCH═CHCH2OH
RCHO+OHCCH2OH
有机物A的相对分子质量Mr(A)是氢气相对分子质量的83倍.A遇FeCl3溶液显紫色,G的分子式为C7H12O,以下A~H均为有机物,其转化关系如下:
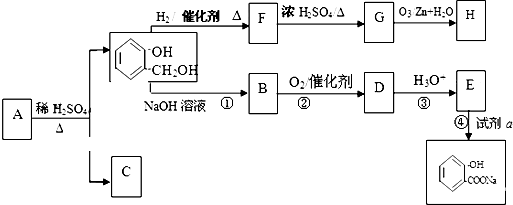
(1)A的结构简式为 ,由F到G的反应类型为 .
(2)反应①的作用是 .
(3)试剂a为 写出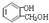 与饱和溴水反应的化学方程式 .
与饱和溴水反应的化学方程式 .
(4)同时满足下列条件的A的所有同分异构体有 种.
Ⅰ.与A有相同的官能团
Ⅱ.属于苯的邻二取代物
Ⅲ.遇FeCl3溶液显紫色
(5)若H与G具有相同碳原子数目,且1mol H能与足量的新制银氨溶液反应生成4mol的单质银.则H的结构简式为 .
(6)由 反应是否进行完全,设计一个简单实验加以证明并写出实验操作、现象及结论为 .
反应是否进行完全,设计一个简单实验加以证明并写出实验操作、现象及结论为 .
| O3/Zn+H2O |
有机物A的相对分子质量Mr(A)是氢气相对分子质量的83倍.A遇FeCl3溶液显紫色,G的分子式为C7H12O,以下A~H均为有机物,其转化关系如下:

(1)A的结构简式为
(2)反应①的作用是
(3)试剂a为
 与饱和溴水反应的化学方程式
与饱和溴水反应的化学方程式(4)同时满足下列条件的A的所有同分异构体有
Ⅰ.与A有相同的官能团
Ⅱ.属于苯的邻二取代物
Ⅲ.遇FeCl3溶液显紫色
(5)若H与G具有相同碳原子数目,且1mol H能与足量的新制银氨溶液反应生成4mol的单质银.则H的结构简式为
(6)由
 反应是否进行完全,设计一个简单实验加以证明并写出实验操作、现象及结论为
反应是否进行完全,设计一个简单实验加以证明并写出实验操作、现象及结论为考点:有机物的推断
专题:有机物的化学性质及推断
分析:A遇FeCl3溶液显紫色,含有酚羟基,A发生水解反应得到C与 ,可知C含有羧基,有机物A的相对分子质量是氢气相对分子质量的83倍,则Mr(A)=83×2=166,
,可知C含有羧基,有机物A的相对分子质量是氢气相对分子质量的83倍,则Mr(A)=83×2=166, 的相对分子质量为124,故C为一元羧酸,则166+18=Mr(C)+124,故Mr(C)=60,可推知C为CH3COOH,则A为
的相对分子质量为124,故C为一元羧酸,则166+18=Mr(C)+124,故Mr(C)=60,可推知C为CH3COOH,则A为 ,由转化关系可知,F为
,由转化关系可知,F为 ,G的分子式为C7H12O,由F、G的分子式可知,F分子内脱去1分子水生成G,属于消去反应,G发生碳碳双键发生臭氧氧化反应生成H,由(5)中若H与G分子具有相同的碳原子数,且1mol H能与足量的新制银氨溶液反应生成4mol单质银,则H中含有2个-CHO,则亚甲基上的-OH不能发生消去反应,可推知G的结构简式为
,G的分子式为C7H12O,由F、G的分子式可知,F分子内脱去1分子水生成G,属于消去反应,G发生碳碳双键发生臭氧氧化反应生成H,由(5)中若H与G分子具有相同的碳原子数,且1mol H能与足量的新制银氨溶液反应生成4mol单质银,则H中含有2个-CHO,则亚甲基上的-OH不能发生消去反应,可推知G的结构简式为 ,故H的结构简式为
,故H的结构简式为 .
. 与氢氧化钠水溶液反应生成B为
与氢氧化钠水溶液反应生成B为 ,B发生氧化反应生成D,D酸化得到E,E与试剂a反应得到
,B发生氧化反应生成D,D酸化得到E,E与试剂a反应得到 ,可推知B中醇羟基被氧化为羧基生成D为
,可推知B中醇羟基被氧化为羧基生成D为 ,则E为
,则E为 ,反应①的目的是保护酚羟基,防止在反应②中被氧化,E转化F是羧基反应,而酚羟基不反应,故试剂a为NaHCO3溶液,据此解答.
,反应①的目的是保护酚羟基,防止在反应②中被氧化,E转化F是羧基反应,而酚羟基不反应,故试剂a为NaHCO3溶液,据此解答.
 ,可知C含有羧基,有机物A的相对分子质量是氢气相对分子质量的83倍,则Mr(A)=83×2=166,
,可知C含有羧基,有机物A的相对分子质量是氢气相对分子质量的83倍,则Mr(A)=83×2=166, 的相对分子质量为124,故C为一元羧酸,则166+18=Mr(C)+124,故Mr(C)=60,可推知C为CH3COOH,则A为
的相对分子质量为124,故C为一元羧酸,则166+18=Mr(C)+124,故Mr(C)=60,可推知C为CH3COOH,则A为 ,由转化关系可知,F为
,由转化关系可知,F为 ,G的分子式为C7H12O,由F、G的分子式可知,F分子内脱去1分子水生成G,属于消去反应,G发生碳碳双键发生臭氧氧化反应生成H,由(5)中若H与G分子具有相同的碳原子数,且1mol H能与足量的新制银氨溶液反应生成4mol单质银,则H中含有2个-CHO,则亚甲基上的-OH不能发生消去反应,可推知G的结构简式为
,G的分子式为C7H12O,由F、G的分子式可知,F分子内脱去1分子水生成G,属于消去反应,G发生碳碳双键发生臭氧氧化反应生成H,由(5)中若H与G分子具有相同的碳原子数,且1mol H能与足量的新制银氨溶液反应生成4mol单质银,则H中含有2个-CHO,则亚甲基上的-OH不能发生消去反应,可推知G的结构简式为 ,故H的结构简式为
,故H的结构简式为 .
. 与氢氧化钠水溶液反应生成B为
与氢氧化钠水溶液反应生成B为 ,B发生氧化反应生成D,D酸化得到E,E与试剂a反应得到
,B发生氧化反应生成D,D酸化得到E,E与试剂a反应得到 ,可推知B中醇羟基被氧化为羧基生成D为
,可推知B中醇羟基被氧化为羧基生成D为 ,则E为
,则E为 ,反应①的目的是保护酚羟基,防止在反应②中被氧化,E转化F是羧基反应,而酚羟基不反应,故试剂a为NaHCO3溶液,据此解答.
,反应①的目的是保护酚羟基,防止在反应②中被氧化,E转化F是羧基反应,而酚羟基不反应,故试剂a为NaHCO3溶液,据此解答.解答:
解:A遇FeCl3溶液显紫色,含有酚羟基,A发生水解反应得到C与 ,可知C含有羧基,有机物A的相对分子质量是氢气相对分子质量的83倍,则Mr(A)=83×2=166,
,可知C含有羧基,有机物A的相对分子质量是氢气相对分子质量的83倍,则Mr(A)=83×2=166, 的相对分子质量为124,故C为一元羧酸,则166+18=Mr(C)+124,故Mr(C)=60,可推知C为CH3COOH,则A为
的相对分子质量为124,故C为一元羧酸,则166+18=Mr(C)+124,故Mr(C)=60,可推知C为CH3COOH,则A为 ,由转化关系可知,F为
,由转化关系可知,F为 ,G的分子式为C7H12O,由F、G的分子式可知,F分子内脱去1分子水生成G,属于消去反应,G发生碳碳双键发生臭氧氧化反应生成H,由(5)中若H与G分子具有相同的碳原子数,且1mol H能与足量的新制银氨溶液反应生成4mol单质银,则H中含有2个-CHO,则亚甲基上的-OH不能发生消去反应,可推知G的结构简式为
,G的分子式为C7H12O,由F、G的分子式可知,F分子内脱去1分子水生成G,属于消去反应,G发生碳碳双键发生臭氧氧化反应生成H,由(5)中若H与G分子具有相同的碳原子数,且1mol H能与足量的新制银氨溶液反应生成4mol单质银,则H中含有2个-CHO,则亚甲基上的-OH不能发生消去反应,可推知G的结构简式为 ,故H的结构简式为
,故H的结构简式为 .
. 与氢氧化钠水溶液反应生成B为
与氢氧化钠水溶液反应生成B为 ,B发生氧化反应生成D,D酸化得到E,E与试剂a反应得到
,B发生氧化反应生成D,D酸化得到E,E与试剂a反应得到 ,可推知B中醇羟基被氧化为羧基生成D为
,可推知B中醇羟基被氧化为羧基生成D为 ,则E为
,则E为 ,反应①的目的是保护酚羟基,防止在反应②中被氧化,E转化F是羧基反应,而酚羟基不反应,故试剂a为NaHCO3溶液,
,反应①的目的是保护酚羟基,防止在反应②中被氧化,E转化F是羧基反应,而酚羟基不反应,故试剂a为NaHCO3溶液,
(1)由上述分析可知,A的结构简式为: ,由F到G的反应类型为:消去反应,故答案为:
,由F到G的反应类型为:消去反应,故答案为: ;消去反应;
;消去反应;
(2)反应①的作用是:是保护酚羟基,防止在反应②中被氧化,故答案为:是保护酚羟基,防止在反应②中被氧化;
(3)E转化F是羧基反应,而酚羟基不反应,故试剂a为NaHCO3溶液, 与饱和溴水反应的化学方程式为:
与饱和溴水反应的化学方程式为:
故答案为:NaHCO3; ;
;
(4)同时满足下列条件的A( )的同分异构体:Ⅰ.与A有相同的官能团,Ⅱ.属于苯的邻二取代物,Ⅲ.遇FeCl3溶液显紫色,含有酚羟基,另外侧链为-OOCCH2CH3,-CH2CH2OOCH,-CH(CH3)OOCH,-COOCCH2CH3,-CH2COOCH3,共有5种,故答案为:5;
)的同分异构体:Ⅰ.与A有相同的官能团,Ⅱ.属于苯的邻二取代物,Ⅲ.遇FeCl3溶液显紫色,含有酚羟基,另外侧链为-OOCCH2CH3,-CH2CH2OOCH,-CH(CH3)OOCH,-COOCCH2CH3,-CH2COOCH3,共有5种,故答案为:5;
(5)由上述分析可知,H的结构简式为 ,故答案为:
,故答案为: ,
,
(6)由 反应若不完全,还会存在酚羟基,设计实验证明其是否反应完全方案为:取少许反应后的有机物于试管中,加入FeCl3溶液,溶液显紫色,则反应物有剩余,反之则完全反应,
反应若不完全,还会存在酚羟基,设计实验证明其是否反应完全方案为:取少许反应后的有机物于试管中,加入FeCl3溶液,溶液显紫色,则反应物有剩余,反之则完全反应,
故答案为:取反应后的有机物少许于试管中,加入FeCl3溶液,溶液显紫色,则反应物有剩余,反之则完全反应.
 ,可知C含有羧基,有机物A的相对分子质量是氢气相对分子质量的83倍,则Mr(A)=83×2=166,
,可知C含有羧基,有机物A的相对分子质量是氢气相对分子质量的83倍,则Mr(A)=83×2=166, 的相对分子质量为124,故C为一元羧酸,则166+18=Mr(C)+124,故Mr(C)=60,可推知C为CH3COOH,则A为
的相对分子质量为124,故C为一元羧酸,则166+18=Mr(C)+124,故Mr(C)=60,可推知C为CH3COOH,则A为 ,由转化关系可知,F为
,由转化关系可知,F为 ,G的分子式为C7H12O,由F、G的分子式可知,F分子内脱去1分子水生成G,属于消去反应,G发生碳碳双键发生臭氧氧化反应生成H,由(5)中若H与G分子具有相同的碳原子数,且1mol H能与足量的新制银氨溶液反应生成4mol单质银,则H中含有2个-CHO,则亚甲基上的-OH不能发生消去反应,可推知G的结构简式为
,G的分子式为C7H12O,由F、G的分子式可知,F分子内脱去1分子水生成G,属于消去反应,G发生碳碳双键发生臭氧氧化反应生成H,由(5)中若H与G分子具有相同的碳原子数,且1mol H能与足量的新制银氨溶液反应生成4mol单质银,则H中含有2个-CHO,则亚甲基上的-OH不能发生消去反应,可推知G的结构简式为 ,故H的结构简式为
,故H的结构简式为 .
. 与氢氧化钠水溶液反应生成B为
与氢氧化钠水溶液反应生成B为 ,B发生氧化反应生成D,D酸化得到E,E与试剂a反应得到
,B发生氧化反应生成D,D酸化得到E,E与试剂a反应得到 ,可推知B中醇羟基被氧化为羧基生成D为
,可推知B中醇羟基被氧化为羧基生成D为 ,则E为
,则E为 ,反应①的目的是保护酚羟基,防止在反应②中被氧化,E转化F是羧基反应,而酚羟基不反应,故试剂a为NaHCO3溶液,
,反应①的目的是保护酚羟基,防止在反应②中被氧化,E转化F是羧基反应,而酚羟基不反应,故试剂a为NaHCO3溶液,(1)由上述分析可知,A的结构简式为:
 ,由F到G的反应类型为:消去反应,故答案为:
,由F到G的反应类型为:消去反应,故答案为: ;消去反应;
;消去反应;(2)反应①的作用是:是保护酚羟基,防止在反应②中被氧化,故答案为:是保护酚羟基,防止在反应②中被氧化;
(3)E转化F是羧基反应,而酚羟基不反应,故试剂a为NaHCO3溶液,
 与饱和溴水反应的化学方程式为:
与饱和溴水反应的化学方程式为:
故答案为:NaHCO3;
 ;
;(4)同时满足下列条件的A(
 )的同分异构体:Ⅰ.与A有相同的官能团,Ⅱ.属于苯的邻二取代物,Ⅲ.遇FeCl3溶液显紫色,含有酚羟基,另外侧链为-OOCCH2CH3,-CH2CH2OOCH,-CH(CH3)OOCH,-COOCCH2CH3,-CH2COOCH3,共有5种,故答案为:5;
)的同分异构体:Ⅰ.与A有相同的官能团,Ⅱ.属于苯的邻二取代物,Ⅲ.遇FeCl3溶液显紫色,含有酚羟基,另外侧链为-OOCCH2CH3,-CH2CH2OOCH,-CH(CH3)OOCH,-COOCCH2CH3,-CH2COOCH3,共有5种,故答案为:5;(5)由上述分析可知,H的结构简式为
 ,故答案为:
,故答案为: ,
,(6)由
 反应若不完全,还会存在酚羟基,设计实验证明其是否反应完全方案为:取少许反应后的有机物于试管中,加入FeCl3溶液,溶液显紫色,则反应物有剩余,反之则完全反应,
反应若不完全,还会存在酚羟基,设计实验证明其是否反应完全方案为:取少许反应后的有机物于试管中,加入FeCl3溶液,溶液显紫色,则反应物有剩余,反之则完全反应,故答案为:取反应后的有机物少许于试管中,加入FeCl3溶液,溶液显紫色,则反应物有剩余,反之则完全反应.
点评:本题考查有机物推断,难度中等,注意根据相对分子质量综合分析确定C为乙酸,再根据反应条件综合分析推断,对学生的分析推理有一定的要求,需要学生熟练掌握官能团的性质与转化.

练习册系列答案
相关题目
用质量均为100g的Cu作电极,电解AgNO3溶液.稍电解一段时间后,两电极的质量相差28g,此时两电极的质量分别为( )
| A、阳极100 g,阴极128 g |
| B、阳极93.6 g,阴极121.6 g |
| C、阳极91.0 g,阴极119.0 g |
| D、阳极86.0 g,阴极114.0 g |
下列实验操作中,用于分离食用油和氯化钠溶液的最佳方案是( )
A、 |
B、 |
C、 |
D、 |
下列说法正确的是( )
| A、过量的铁在氯气中燃烧可生成氯化亚铁 |
| B、向Fe(NO3)2溶液加入盐酸,由于酸性增强抑制Fe2+的水解,使c(Fe2+)增大 |
| C、Fe和Fe2O3的混合物溶于盐酸中,再加入KSCN溶液,溶液一定变为血红色 |
| D、把一定量的铁和铜的混和粉未投入到FeCl3溶液中,不可能出现只有铁剩余没有铜剩余的情况 |


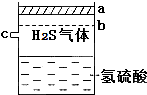 已知多元弱酸在水溶液中的电离是分步进行的,且第一步的电离程度大于第二步的电离程度,第二步的电离程度远大于第三步的电离程度…在密闭容器里盛有饱和H2S溶液和H2S气体,可上下移动的活塞停止在a处,如图所示.
已知多元弱酸在水溶液中的电离是分步进行的,且第一步的电离程度大于第二步的电离程度,第二步的电离程度远大于第三步的电离程度…在密闭容器里盛有饱和H2S溶液和H2S气体,可上下移动的活塞停止在a处,如图所示.