题目内容
 已知元素
已知元素(1)R基态原子的电子排布式为
(2)化合物XZ3的空间构型为
(3)Z的氢化物由固体变为气态所需克服的微粒间的作用力是
(4)Z、W、R形成某种化合物的晶胞结构如右图所示,其化学式为
(5)XY2-能被酸性KMnO4溶液氧化,其中MnO4-被还原为Mn2+,反应的离子方程式是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、W、R为前四周期元素,且原子序数依次增大,Z、W分别是短周期中电负性最大和最小的元素,则Z为氟元素,W为钠元素,X基态原子核外有三个未成对电子,所以X在第ⅤA族,原子序数小于Z,所以X为氮元素,Y的原子序数介于X、Z之间,所以Y为氧元素,R2+离子的3d轨道中有三对成对电子,所以R为镍元素,据此答题;
解答:
解:X、Y、Z、W、R为前四周期元素,且原子序数依次增大,Z、W分别是短周期中电负性最大和最小的元素,则Z为氟元素,W为钠元素,X基态原子核外有三个未成对电子,所以X在第ⅤA族,原子序数小于Z,所以X为氮元素,Y的原子序数介于X、Z之间,所以Y为氧元素,R2+离子的3d轨道中有三对成对电子,所以R为镍元素,
(1)R为镍元素,是28号元素,其基态原子的电子排布式为1S22S22P63S23P63d84S2,元素X、Y、Z分别为N、O、F,根据元素周期律,同一周期中从左向右,第一电离能逐渐增大,但由于氮原子最外层p轨道处于半满状态,第一电离能高于相邻主族同周期元素,所以N、O、F的第一电离能由大到小的顺序为F>N>O,
故答案为:1S22S22P63S23P63d84S2;F>N>O;
(2)化合物XZ3为NF3,其中心原子氮原子的价层电子对数为
=4,有一对孤电子对,所以NF3的空间构型为三角锥形,Ni2+与NH3形成的配离子中,NH3做配体,氮原子提供孤对电子,故答案为:三角锥形;N;
(3)由于HF分子间存在着氢键,所以HF由固体变为气态所需克服的微粒间的作用力是有氢键和范德华力,故答案为:氢键和范德华力;
(4)Z、W、R分别为F、Na、Ni根据晶胞结构图利用均摊法可知,在每个晶胞中含有F原子的个数为12×
=3,Ni原子的个数为8×
=1,Na原子的个数为1,所以其化学式为NaNiF3,故答案为:NaNiF3;
(5)XY2-为NO2-,被酸性KMnO4溶液氧化,其中MnO4-被还原为Mn2+,NO2-被氧化成NO3-,根据电荷守恒和元素守恒可知,反应的离子方程式为5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O,故答案为:5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O;
(1)R为镍元素,是28号元素,其基态原子的电子排布式为1S22S22P63S23P63d84S2,元素X、Y、Z分别为N、O、F,根据元素周期律,同一周期中从左向右,第一电离能逐渐增大,但由于氮原子最外层p轨道处于半满状态,第一电离能高于相邻主族同周期元素,所以N、O、F的第一电离能由大到小的顺序为F>N>O,
故答案为:1S22S22P63S23P63d84S2;F>N>O;
(2)化合物XZ3为NF3,其中心原子氮原子的价层电子对数为
| 5+3 |
| 2 |
(3)由于HF分子间存在着氢键,所以HF由固体变为气态所需克服的微粒间的作用力是有氢键和范德华力,故答案为:氢键和范德华力;
(4)Z、W、R分别为F、Na、Ni根据晶胞结构图利用均摊法可知,在每个晶胞中含有F原子的个数为12×
| 1 |
| 4 |
| 1 |
| 8 |
(5)XY2-为NO2-,被酸性KMnO4溶液氧化,其中MnO4-被还原为Mn2+,NO2-被氧化成NO3-,根据电荷守恒和元素守恒可知,反应的离子方程式为5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O,故答案为:5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O;
点评:本题主要考查了第一电离能、分子空间构型、晶胞的计算、氧化还原反应等知识点,中等难度,综合性较强,解题时注意根据原子结构的特点确定元素种类.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
NA表示阿伏伽德罗常数,下列叙述正确的是( )
| A、1 mol Na2O2固体中含离子总数为4NA |
| B、将含0.1 mol FeCl3的饱和溶液制成胶体后,生成0.1NA个Fe(OH)3胶粒 |
| C、高温下,0.3 mol Fe与足量水蒸气反应,生成的H2分子数目为0.4 NA |
| D、1 mol FeI2与足量氯气反应时转移的电子数为2NA |
常温下,下列各组离子在指定溶液中可能大量存在的( )
| A、由水电离出来的c(H+)=10-12 mol?L-1的溶液中:Cl-、CO32-、K+、SO32- |
| B、含有大量AlO2-的溶液中:K+、Al3+、Br-、HCO3- |
| C、使甲基橙变红的溶液中:Fe2+、K+、NO3-、SO42- |
| D、使pH试纸变深蓝色的溶液中:Cl-、K+、Mg2+、SO32- |
下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A、常温下,将pH=2的盐酸和pH=12的氨水等体积混合:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| B、0.1mol?L-1 Na2CO3溶液:c(Na+)=c(HCO3-)+2c(CO32-)+2c(H2CO3) |
| C、0.1mol?L-1 NH4Cl溶液:c(NH4+)=c( Cl-) |
| D、向醋酸钠溶液加适量醋酸,得到的混合溶液:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )


| A、最高价氧化物对应水化物的酸性:Q<W |
| B、最简单气态氢化物的热稳定性:R>Q |
| C、含T的盐中,T元素只能存在于阳离子中 |
| D、原子半径:T>Q>R |
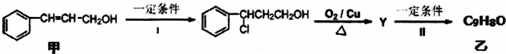
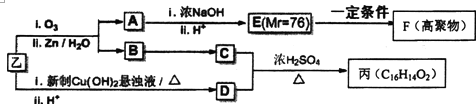
 CuCl是应用广泛的有机合成催化剂,也在染料工业中用作实效型气体吸收剂.利用废旧印刷电路板制氯化亚铜可减少污染、实现资源再生.请回答下列问题:
CuCl是应用广泛的有机合成催化剂,也在染料工业中用作实效型气体吸收剂.利用废旧印刷电路板制氯化亚铜可减少污染、实现资源再生.请回答下列问题: