题目内容
16.I.高炉炼铁的主要反应为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.已知该反应的△H<0,在1000℃时,K=64.在1000℃的条件下,在容积10L的密闭容器中,加入Fe、Fe2O3、CO、CO2各1.0moI,反应经10min后达到平衡.(1)该时间范围内的平均反应速率v(CO2)=0.006mol/(L•min)
(2)CO的转化率60%.
(3)欲提高CO的平衡转化率,可采取的措施是D.
A.减少Fe的量 B.增加Fe2O3的量
C.升高反应温度 D.移出部分CO2
E.使用合适的催化剂 F.减少容器的容积
Ⅱ.已知化学反应:
①Fe(s)+CO2(g)?FeO(s)+CO(g),平衡常数为K1
②Fe(s)+H2O(g)?FeO(s)+H2(g),平衡常数为K2.
在温度973K和1173K情况下,K1、K2的值分别如下:
| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
(5)现有反应③:该反应的平衡常数的数学表达式K3=$\frac{c(CO).c({H}_{2}O)}{c(C{O}_{2}).c({H}_{2})}$.
(6)根据反应①和②可以推导出K1、K2与K3之间的关系式,K3=$\frac{{K}_{1}}{{K}_{2}}$.据此关系式和上表数据,也能推断出反应③的△H>0(填“>”“<”).
分析 (1)该条件下浓度商=$\frac{1.{0}^{3}}{1.{0}^{3}}$=1.0<64,平衡正向移动,
设参加反应的二氧化碳物质的量为xmol,则反应达到平衡状态时参加反应的n(CO)=n(CO2)=xmol,平衡时c(CO)=$\frac{1-x}{10}$mol/L、c(CO2)=$\frac{1+x}{10}$mol/L,K=($\frac{\frac{1+x}{10}}{\frac{1-x}{10}}$)3=64,x=0.6,根据v=$\frac{\frac{△n}{V}}{△t}$计算二氧化碳平均反应速率;
(2)参加反应的n(CO)=0.6mol,CO转化率=$\frac{参加反应的n(CO)}{反应初始n(CO)}$×100%;
(3)该反应的正反应是放热反应,要提高CO转化率应该使平衡正向移动但不能通过增大CO浓度来实现;
(4)升高温度平衡向吸热方向移动,根据化学平衡常数确定反应热;
(5)将方程式①-②得方程式③,化学平衡常数K等于生成物浓度幂之积与反应物浓度幂之积的比;
(6)化学方程式相减,化学平衡常数相除;根据温度和化学平衡常数关系确定反应热.
解答 解:(1)该条件下浓度商=$\frac{1.{0}^{3}}{1.{0}^{3}}$=1.0<64,平衡正向移动,
设参加反应的二氧化碳物质的量为xmol,则反应达到平衡状态时参加反应的n(CO)=n(CO2)=xmol,平衡时c(CO)=$\frac{1-x}{10}$mol/L、c(CO2)=$\frac{1+x}{10}$mol/L,K=($\frac{\frac{1+x}{10}}{\frac{1-x}{10}}$)3=64,x=0.6,v(CO2)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{0.6mol}{10L}}{10min}$=0.006mol/(L.min);
故答案为:0.006;
(2)参加反应的n(CO)=0.6mol,CO转化率=$\frac{参加反应的n(CO)}{反应初始n(CO)}$×100%=$\frac{0.6mol}{1.0mol}$×100%=60%,
故答案为:60%;
(3)A.Fe是固体,Fe的多少不影响平衡移动,所以减少Fe的量不影响平衡移动,则不能提高CO转化率,故错误;
B.氧化铁是固体,增加Fe2O3的量不影响平衡移动,则不能提高CO转化率,故错误;
C.该反应的正反应是放热反应,升高反应温度平衡逆向移动,CO转化率降低,故错误;
D.移出部分CO2,二氧化碳浓度降低,平衡正向移动,提高CO转化率,故正确;
故选D;
(4)升高温度化学平衡常数增大,说明正反应是吸热反应,则△H>0,
故答案为:>;
(5)将方程式①-②得方程式③为H2(g)+CO2(g)?H2O(g)+CO(g),化学平衡常数K=$\frac{c(CO).c({H}_{2}O)}{c(C{O}_{2}).c({H}_{2})}$,
故答案为:$\frac{c(CO).c({H}_{2}O)}{c(C{O}_{2}).c({H}_{2})}$;
(6)化学方程式相减化学平衡常数相除,则K3=$\frac{{K}_{1}}{{K}_{2}}$,973K时$\frac{{K}_{1}}{{K}_{2}}$=$\frac{1.47}{2.38}$=0.62、1173K时$\frac{{K}_{1}}{{K}_{2}}$=$\frac{2.15}{1.67}$=1.29》0.62,升高温度化学平衡常数增大,则正反应是吸热反应,△H>0,
故答案为:$\frac{{K}_{1}}{{K}_{2}}$;>.
点评 本题考查化学平衡计算,为高频考点,涉及化学平衡常数与温度关系、化学平衡计算、化学平衡影响因素等知识点,侧重考查学生分析判断及计算能力,注意:固体或纯液体不影响平衡移动,题目难度不大.

| A. | 用醋酸溶解大理石:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| B. | 向氯化铝溶液中滴加过量氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| C. | 向碳酸氢钙溶液中加入少量烧碱溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+H2O | |
| D. | 亚硫酸钠溶液中滴加酸性高锰酸钾溶液:5SO32-+6H++2MnO4-=5SO42-+2Mn2++3H2O |
| A. | 聚乙烯是无毒高分子化合物,可用作食品包装 | |
| B. | 人体内的蛋白质不断分解,最终生成水和二氧化碳排出体外 | |
| C. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油 | |
| D. | 电子垃圾的回收利用,可减少对土壤和水源的污染 |
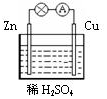
| A. | 锌是该电池的负极 | |
| B. | 锌电极上发生氧化反应 | |
| C. | 铜电极的电极反应式为:2H++2e-=H2↑ | |
| D. | 若将电解质溶液换成AgNO3溶液,两电极的反应式均发生改变 |





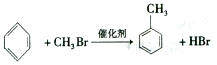 ;②C物质苯环上一卤代物只有两种.
;②C物质苯环上一卤代物只有两种. .
. $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$
 +
+
 .
.
