题目内容
17.某有机物A的相对分子质量为94.5,在一定条件下可以发生如下转化(其他产物和水已省略).请回答下列问题:
(1)按要求写化学式:A的分子式C3H7OCl; J的结构简式
 ;
;(2)在上述反应中①~⑨反应中,属于取代反应的是⑤⑨,属于消去反应的是③④;
(3)写出下列反应的化学方程式:B→C
 C→F
C→F +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$ +NaCl+H2O
+NaCl+H2O(4)有机物I在一定条件下,可合成一种环保型的高分子材料,则该高分子材料的结构简式为
 ;
;(5)写出 I的一种同分异构体(能与金属钠、NaOH溶液和银氨溶液均能反应)的结构简式为HCOOCH2CH2OH.
分析 有机物A可以连续发生氧化反应,含有伯醇结构,B氧化得到C,C水解反应得到F,则A含有卤素原子,其相对分子质量为94.5,则含有卤素原子为Cl,且含有1个Cl原子,去掉1个-Cl、-OH剩余总相对原子质量为94.5-35.5-17=42,剩余基团为-C3H6-,而F酸化得到I,则I分子中含有-OH、-COOH,I发生酯化反应得到六元环状化合物J,只能是2分子I发生酯化反应得到环酯,故I分子中-OH、-COOH连接同一碳原子上,则I为 ,故J为
,故J为 ,转化过程转化碳骨架不变,故A为
,转化过程转化碳骨架不变,故A为 ,则B为
,则B为 ,C为
,C为 ,F为
,F为 ;
;
B在氢氧化钠醇溶液、加热条件下发生消去反应生成E,则E为CH2=CHCHO,E与氢气发生加成反应生成H,则H为CH3CH2CH2OH;
有机物A在浓硫酸、加热条件下发生消去反应生成D,则D为CH3C(Cl)=CH2,D在一定条件下生成高聚物G,则G为 ,据此解答.
,据此解答.
解答 解:有机物A可以连续发生氧化反应,含有伯醇结构,B氧化得到C,C水解反应得到F,则A含有卤素原子,其相对分子质量为94.5,则含有卤素原子为Cl,且含有1个Cl原子,去掉1个-Cl、-OH剩余总相对原子质量为94.5-35.5-17=42,剩余基团为-C3H6-,而F酸化得到I,则I分子中含有-OH、-COOH,I发生酯化反应得到六元环状化合物J,只能是2分子I发生酯化反应得到环酯,故I分子中-OH、-COOH连接同一碳原子上,则I为 ,故J为
,故J为 ,转化过程转化碳骨架不变,故A为
,转化过程转化碳骨架不变,故A为 ,则B为
,则B为 ,C为
,C为 ,F为
,F为 ;
;
B在氢氧化钠醇溶液、加热条件下发生消去反应生成E,则E为CH2=CHCHO,E与氢气发生加成反应生成H,则H为CH3CH2CH2OH;
有机物A在浓硫酸、加热条件下发生消去反应生成D,则D为CH3C(Cl)=CH2,D在一定条件下生成高聚物G,则G为 ,
,
(1)由上述分析可知,A的结构简式为: ,分子式为C3H7OCl;J的结构简式为:
,分子式为C3H7OCl;J的结构简式为: ,
,
故答案为:C3H7OCl; ;
;
(2)上述①-⑨的反应中,⑤⑨属于取代反应,③④属于消去反应,
故答案为:⑤⑨;③④;
(3)B生成C的方程式为 ;
;
C为 ,F为
,F为 ,C生成F反应方程式为
,C生成F反应方程式为 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$ +NaCl+H2O;
+NaCl+H2O;
故答案为: ;
; +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$ +NaCl+H2O;
+NaCl+H2O;
(4)I生成高分子化合物结构简式为 ,故答案为:
,故答案为: ;
;
(5)I为 ,I的一种同分异构体能与Na反应、NaOH反应、银氨溶液反应,说明该物质中含有羟基、酯基、醛基,其中一种结构简式为HCOOCH2CH2OH,
,I的一种同分异构体能与Na反应、NaOH反应、银氨溶液反应,说明该物质中含有羟基、酯基、醛基,其中一种结构简式为HCOOCH2CH2OH,
故答案为:HCOOCH2CH2OH.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断能力,根据反应条件综合分析有机物A、I含有的官能团,再结合I形成六元环化合物确定A、I结构简式,进而推断其它物质,需要学生熟练掌握官能团的性质与转化,题目难度中等.

 某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.所用HNO3浓度为1.00mol•L-1、2.00mol•L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3的用量为25.0mL、大理石用量为10.00g.
某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.所用HNO3浓度为1.00mol•L-1、2.00mol•L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3的用量为25.0mL、大理石用量为10.00g.请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 大理石规格 | HNO3浓度/mol•L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探 究大理石规格(粗、细)对该反 应速率的影响;) |
| ② | ||||
| ③ | ||||
| ④ |
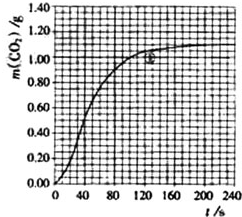
实验①在70-90s范围内HNO3的平均反应速率(忽略溶液体积变化,写出计算过程)为由图可知70至90S,CO2生成的质量为m(CO2)=0.95g-0.84g=0.11g,物质的量为n(CO2)=0.0025mol,
由$\frac{1}{2}$CaCO3+HNO3═$\frac{1}{2}$Ca(NO3)2+$\frac{1}{2}$CO2↑+$\frac{1}{2}$H2O可知消耗HNO3的物质的量为n(HNO3)=0.0025mol×2=0.005mol,
又溶液体积为25ml=0.025L,所以HNO3减少的浓度△c(HNO3)=$\frac{△n}{V}$=$\frac{0.005mol}{0.025L}$=0.2mol•L-1,
反应时间为90s-70s=20s,所以HNO3在70-90S范围内的平均反应速率为v(HNO3)=$\frac{△c}{△t}$=$\frac{0.2mol•{L}^{-1}}{20s}$=0.01mol•L-1•S-1,
答:70-90s范围内HNO3的平均反应速率为0.01mol•L-1•S-1..
| A. | ⅠA元素的电负性从上到下逐渐减小,而ⅦA元素的电负性从上到下逐渐增大 | |
| B. | 最外层电子排布为ns2np6(若只有K层时为1s2)的原子,第一电离能较大 | |
| C. | 碳原子由1s22s22p2转化成1s22s12p3,这一过程中释放能量 | |
| D. | NaH的存在能支持可将氢元素放在ⅦA的观点 |
| A. | 氯水中:c(Cl2)═2[c(ClO-)+c(Cl-)+C(HClO)] | |
| B. | 氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-) | |
| C. | 等体积等浓度的氢氧化钠与醋酸混合:c(Na+)>c(CH3COO-) | |
| D. | Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+) |
| A. | Fe2O3-Fe | B. | H2-H2O | C. | KClO3-KCl | D. | CO2-CaCO3 |
 的系统命名是3,4-二甲基-2-戊烯.将其在催化剂存在下完全氢化,所得烷烃的系统命名是2,3-二甲基戊烷.
的系统命名是3,4-二甲基-2-戊烯.将其在催化剂存在下完全氢化,所得烷烃的系统命名是2,3-二甲基戊烷. X,Y,Z,R,W均为周期表中前四周期的元素,其原子序数依次增大;x2-和Y+有相同的核外电子排布;Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气态单质.回答下列间题(相关回答均用元素符号表示):
X,Y,Z,R,W均为周期表中前四周期的元素,其原子序数依次增大;x2-和Y+有相同的核外电子排布;Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气态单质.回答下列间题(相关回答均用元素符号表示):