题目内容
5.(1)有机物CH3CH(C2H5)CH(C2H5)CH(CH3)2按系统命名法命名的名称是2,4-二甲基-3-乙基己烷.(2)卤代烃C5H11Cl中含有2个-CH3的同分异构体有4种.
(3)已知乙炔(C2H2)、苯(C6H6)、乙醛(C2H4O)的混合气体中含氧元素的质量分数为8%,则混合气体中碳元素的质量分数为84%.
分析 (1)烷烃的命名原则:碳链最长称某烷,靠近支链把号编.简单在前同相并,其间应划一短线.
1、碳链最长称某烷:选定分子里最长的碳链做主链,并按主链上碳原子数目称为“某烷“.
2、靠近支链把号编:把主链里离支链较近的一端作为起点,用1、2、3…等数字给主链的各碳原子编号定位以确定支链的位置.
3、简单在前同相并,其间应划一短线:把支链作为取代基,把取代基的名称写在烷烃名称的前面,在取代基的前面用阿拉伯数字注明它在烷烃主链上的位置,而且简单的取代基要写在复杂的取代基前面,如果有相同的取代基,则要合并起来用二、三等数字表示,但是表示相同的取代基位置的阿拉伯数字要用逗号隔开,并在号数后面连一短线,中间用“-“隔开;
(2)戊烷存在正戊烷、异戊烷和新戊烷3种同分异构体,分别写出三者的一氯代物的结构简式,然后判断含有2个甲基的同分异构体的数目;
(3)乙醛(C2H4O)可以表示为C2H2.H2O,故乙炔(C2H2)、苯(C6H6)、乙醛(C2H4O)的混合气体可以看做C6H6、C2H2、H2O的混合物,进一步看作CH、H2O的混合物,根据O元素的分数计算H2O的质量分数,进而计算CH的质量分数,再根据CH中C、H质量之比为12:1,据此计算C元素的质量分数.
解答 解:(1)CH3CH(C2H5)CH(C2H5)CH(CH3)2,按烷烃的命名规则,首先必须选择分子结构中的最长碳链为主链,该有机物最长碳链含有6个C,主链为己烷,编号从右边开始,满足取代基编号之和最小原则,在2号、4号C上各含有一个甲基,3号碳上有一个乙基,该有机物命名为:2,4-二甲基-3-乙基己烷,
故答案为:2,4-二甲基-3-乙基己烷;
(2)分子式为C5H11Cl的同分异构体有:
主链有5个碳原子的为:CH3CH2CH2CH2CH2Cl;CH3CH2CH2CHClCH3;CH3CH2CHClCH2CH3,其中含有两个甲基的有2种;
链有4个碳原子的为:CH3CH(CH3)CH2CH2Cl;CH3CH(CH3)CHClCH3;CH3CCl(CH3)CH2CH3;CH2ClCH(CH3)CH2CH3,其中含有2个甲基的有1种;
有3个碳原子的为:CH2C(CH3)2CH2Cl,其分子中含有2个甲基,
所以满足条件的有机物的同分异构体有:2+1+1=4种,
故答案为:4;
(3)解:乙醛(C2H4O)可以表示为C2H2.H2O,故乙炔(C2H2)、苯(C6H6)、乙醛(C2H4O)的混合气体可以看做C6H6、C2H2、H2O的混合物,进一步看作CH、H2O的混合物,O元素的分数为8%,故H2O的质量分数为$\frac{8%}{\frac{16}{18}}$×100%=9%,故CH的质量分数1-9%=91%,CH中C、H质量之比为12:1,故C元素的质量分数为91%×$\frac{12}{13}$=84%,
故答案为:84%.
点评 本题考查了物质命名、同分异构体的书写、混合物中元素质量分数的计算,题目难度中等,掌握同分异构体的概念及书写原则为解答关键,注意明确题中限制条件,试题培养了学生灵活应用基础知识的能力.

| A. | 该电池正极反应式为:2MnO2+2e-+2H2O═2MnOOH+2OH- | |
| B. | 该电池反应中MnO2起催化作用 | |
| C. | 该电池工作时电流由Zn经导线流向MnO2 | |
| D. | 该电池中Zn作负极,发生还原反应 |
 醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备1一溴丁烷的反应和实验装置如图:
醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备1一溴丁烷的反应和实验装置如图:NaBr+H2SO4$\frac{\underline{\;微热\;}}{\;}$HBr+NaHSO4①
C4H9-OH+HBr$\stackrel{△}{→}$ C4H9-Br+H2O②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等.
有关数据列表如表:
| 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | |
| 正丁醇 | -89.53 | 117.25 | 0.81 |
| 1-溴丁烷 | -112.4 | 101.6 | 1.28 |
(2)制备操作中,加入的浓硫酸必须进行适当稀释,其目的是abc(填字母序号).
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(3)反应结束后,将反应混合物中1-溴丁烷分离出来,应采取蒸馏操作得到较纯的1-溴丁烷,蒸馏装置除了用到冷凝管、温度计、牛角管、锥形瓶,还需要的玻璃仪器是酒精灯、蒸馏烧瓶;
(4)将反应结束后得到的混合物经过蒸馏操作得到较纯的1-溴丁烷的产物中,可能含有的杂质主要是水;
(5)将1-溴丁烷产品置于分液漏斗中加水,振荡后静置,产物在下层(填“上层”、“下层”或“不分层”).
(6)某实验小组制取1-溴丁烷时,向圆底烧瓶中加入7.4g正丁醇,13.0g NaBr和足量的浓硫酸,最终制得1一溴丁烷9.6g,则1一溴丁烷的产率是70%(保留2位有效数字).
| A. | 24:9 | B. | 2:1 | C. | 1:2 | D. | 9:24 |
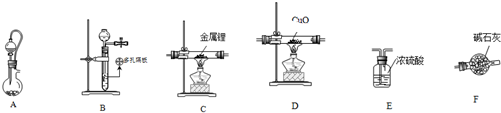
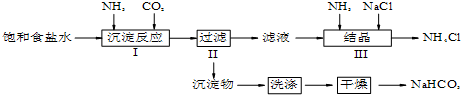
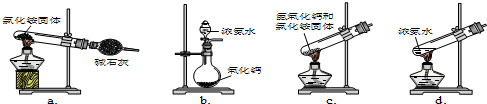
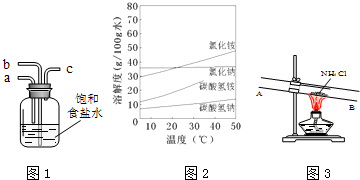
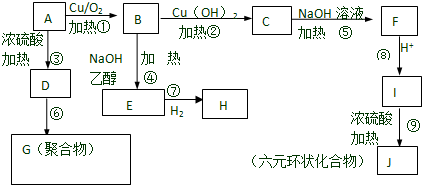
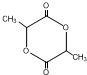 ;
;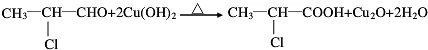 C→F
C→F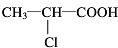 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$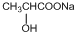 +NaCl+H2O
+NaCl+H2O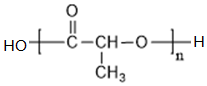 ;
;