题目内容
9.以下关于混合物分离提纯操作或原理说法正确的是( )| A. | 实验室中用含有Ca2+、Mg2+、Cl-的自来水制取蒸馏水,可采用蒸馏的方法 | |
| B. | 用CCl4萃取碘水的实验中,振荡静置后,上层为紫红色溶液 | |
| C. | 利用植物油的密度比水小的原理,可用分液的方法分离这两种液体混合物 | |
| D. | 蒸馏时,温度计的水银球应充分接触溶液 |
分析 A.含有Ca2+、Mg2+、Cl-的自来水中水的沸点较低;
B.CCl4的密度比水的密度大;
C.分液分离分层的液体混合物;
D.蒸馏时,温度计测定馏分的温度.
解答 解:A.含有Ca2+、Mg2+、Cl-的自来水中水的沸点较低,则制取蒸馏水,可采用蒸馏的方法,故A正确;
B.CCl4的密度比水的密度大,则用CCl4萃取碘水的实验中,振荡静置后,下层为紫红色溶液,故B错误;
C.分液分离分层的液体混合物,与二者的密度无关,故C错误;
D.蒸馏时,温度计测定馏分的温度,则温度计的水银球在烧瓶的支管口处,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、混合物分离提纯实验、实验操作和技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.下列物质既能通过单质间化合反应制取,也能通过单质与盐酸反应制取的是( )
| A. | CuCl2 | B. | FeCl2 | C. | FeCl3 | D. | NaCl |
20.已知反应:2NO2(红棕色)?N204(无色)△H<0.将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )
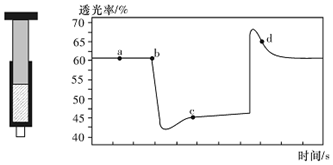

| A. | b点的操作是拉伸注射器 | |
| B. | d点:v(正)>v(逆) | |
| C. | c点与a点相比,c(N02)增大,c(N204)减小,若容器绝热则平衡常数Ka>Kc | |
| D. | 若不忽略体系温度变化,且没有能量损失,则T(b)<T(c) |
17.下列说法或表示正确的是( )
| A. | 若将等量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由“c(石墨)=c(金刚石)△H=+1.9KJ/mol”可知,金刚石没有石墨稳定 | |
| C. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H1,CH3COOH(aq)+OH-(aq)═H2O(l)+CH3COO-(aq)△H2,则△H1>△H2 | |
| D. | 在101KPa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=285.8KJ/mol |
4.已知金属钠和水反应的化学方程式为:2Na+2H2O═2NaOH+H2↑.将9.2g金属钠投入到足量的重水D2O中,则产生的气体中含有( )
| A. | 0.2 mol中子 | B. | 0.4 mol电子 | C. | 0.2 mol质子 | D. | 0.4 mol分子 |
14.向装有乙醇的烧杯中投入一小块金属钠,下列对该实验现象的描述中正确的是( )
| A. | 钠块沉在乙醇液面的下面 | B. | 钠块熔化成小球 | ||
| C. | 钠块在乙醇的液面上游动 | D. | 钠块表面有气泡产生 |
1. 反应:L(s)+aG(g)?bR(g)达到平衡,温度和压强对该反应的影响如图所示,图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气体中G的体积分数.据此可判断( )
反应:L(s)+aG(g)?bR(g)达到平衡,温度和压强对该反应的影响如图所示,图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气体中G的体积分数.据此可判断( )
 反应:L(s)+aG(g)?bR(g)达到平衡,温度和压强对该反应的影响如图所示,图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气体中G的体积分数.据此可判断( )
反应:L(s)+aG(g)?bR(g)达到平衡,温度和压强对该反应的影响如图所示,图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气体中G的体积分数.据此可判断( )| A. | 上述反应是放热反应 | B. | a>b | ||
| C. | 上述反应是吸热反应 | D. | 无法确定a、b的大小 |
19.标准状况下,现有①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g H2S ④0.2molNH3,对这四种气体的氢原子个数由大到小的顺序排列正确的是( )
| A. | ②>③>①>④ | B. | ②>③>④>① | C. | ①>④>②>③ | D. | ①>③>④>② |
 .
.