题目内容
7.如图所示装置可用于二氧化锰与浓盐酸在加热条件下制取氯气,并利用产物进行后续实验,请填写下列空白: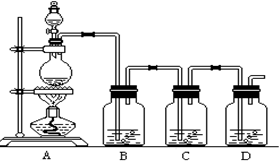
(1)写出二氧化锰与浓盐酸反应的化学方程式:4HCl(浓)+MnO2═△═MnCl2+Cl2↑+2H2O;
(2)洗气瓶B中放有饱和食盐水、洗气瓶C中放有品红溶液,在洗气瓶D中放有石灰乳,则C瓶中观察到的现象是品红褪色;D瓶中发生的化学反应方程式是2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(3)在该反应中盐酸和二氧化锰反应,盐酸充当的是还原剂(氧化剂/还原剂).
(4)若反应产生了标况下11.2L的氯气,则参与氧化还原反应的盐酸的物质的量是1mol.
分析 (1)二氧化锰与浓盐酸反应生成氯化锰、氯气和水;
(2)洗气瓶C中放有品红溶液,氯气通入口红溶液使品红褪色;在洗气瓶D中放有石灰乳,氯气和石灰乳反应生成氯化钙和次氯酸钙、水;
(3)在该反应中盐酸和二氧化锰反应,盐酸中氯的化合价升高,充当的是还原剂;
(4)盐酸参加氧化还原反应生成氯气,根据氯守恒参与氧化还原反应的盐酸的物质的量是盐酸的2倍.
解答 解:(1)二氧化锰与浓盐酸反应生成氯化锰、氯气和水,化学反应方程式为:4HCl(浓)+MnO2═△═MnCl2+Cl2↑+2H2O,故答案为:4HCl(浓)+MnO2═△═MnCl2+Cl2↑+2H2O;
(2)洗气瓶C中放有品红溶液,氯气通入口红溶液使品红褪色;在洗气瓶D中放有石灰乳,氯气和石灰乳反应生成氯化钙和次氯酸钙、水,反应方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,故答案为:品红褪色;2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(3)在该反应中盐酸和二氧化锰反应,盐酸中氯的化合价升高,充当的是还原剂,故答案为:还原剂;
(4)盐酸参加氧化还原反应生成氯气,根据氯守恒参与氧化还原反应的盐酸的物质的量是盐酸的2倍,所以参与氧化还原反应的盐酸的物质的量是$\frac{11.2L}{22.4L/mol}×2$=1 mol,故答案为:1 mol.
点评 本题考查了氯气的实验室制法和氯气的性质、氧化还原反应的规律,解题关键在于明确实验室制备氯气的原理和氯气的性质,题目难度中等.

练习册系列答案
相关题目
17.能正确表示下列反应的离子方程式的是( )
| A. | 将铁粉加入稀硫酸中:2Fe+6H+═Fe3++3H2↑ | |
| B. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+═3Fe3++4H2O | |
| C. | 将氯化亚铁溶液和稀硝酸混合:3Fe2++4H++NO3-═3Fe3++2H2O+NO↑ | |
| D. | 将铁屑加入Fe3+溶液中:Fe3++Fe═2Fe2+ |
18.今有高聚物
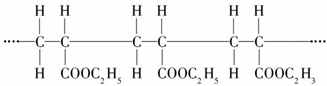
下列对此高聚物的分析中,正确的是( )

下列对此高聚物的分析中,正确的是( )
| A. | 其单体是CH2=CH2和HCOOC2H5 | B. | 这是缩聚反应产物 | ||
| C. | 其链节是CH3CH2-COOC2H5 | D. | 其单体是CH2=CH-COOC2H5 |
15.一定温度时,测得纯水中c(OH-)=2.5×10-7 mol•L-1,则c(H+)为( )
| A. | 2.5×10-7 mol•L-1 | B. | 1.0×10-7 mol•L-1 | ||
| C. | $\frac{1×1{0}^{-14}}{2.5×1{0}^{-7}}$mol•L-1 | D. | 无法确定c(H+) |
2.下列化学用语中,正确的是( )
| A. | 钠原子结构式意图为 | B. | 氕和氘互为同位素 | ||
| C. | 含有7个中子的碳原子符号${\;}_{13}^{7}$C | D. | 碳酸银的化学式:AgCO3 |
12.下列实验操作中错误的是( )
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体也从下口放出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 可用CCl4萃取溴水中的溴单质 | |
| D. | 称量时称量物放在称量纸上,置于托盘天平的左盘,砝码放在托盘天平的右盘中 |
16.下列各组物质中,不满足组内任意两种物质在一定条件下(可以配成水溶液)均能发生反应的是( )
| A. | Al203、HCl、NaOH | B. | NH3、O2、HNO3 | ||
| C. | SiO2、NaOH、HF | D. | CO2、Ca(OH)2、Na2CO3 |
 .
.